Введение
В исследовании III фазы ASCEMBL проводилось сравнение эффективности и безопасности двух режимов терапии (асциминиб, в дозировке 40 мг два раза в сутки и бозутиниб, в дозировке 500 мг один раз в сутки), в популяции пациентов с хроническим миелолейкозом в хронической фазе (ХМЛ-ХФ), получавших ранее ≥ 2 АТФ-конкурентных ингибиторов тирозинкиназ (ИТК).1 Важно отметить, что ASCEMBL являлось первым контролируемым исследованием по сравнению различных препаратов ИТК при ХМЛ у пациентов с резистентностью/непереносимостью в анамнезе. В данном анализе представлены обновленные данные по итогам 4 лет последующего наблюдения.2,3,4
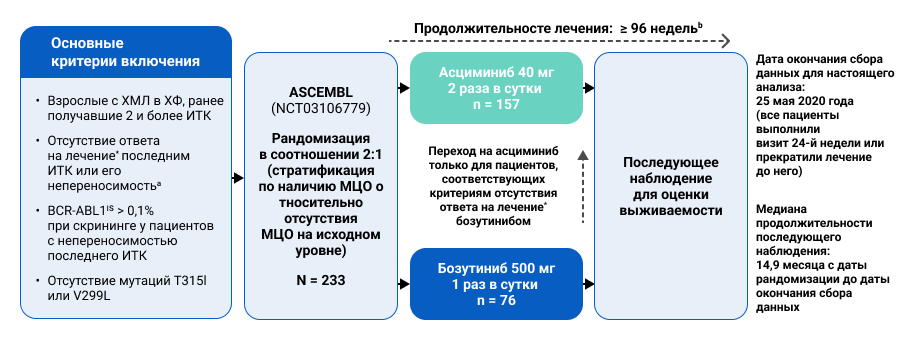
В исследовании участвовали 233 пациента с ХМЛ-ХФ в возрасте ≥ 18 лет, получавшие ранее не менее 2 ИТК, и при условии непереносимости или отсутствия ответа на фоне данной терапии (в соответствие с критериями отсутствия ответа согласно рекомендациям Европейской организации по лечению лейкозов 2013 года).1,5 Пациенты были рандомизированы в соотношении 2:1 в группу терапии асциминибом в дозировке 40 мг два раза в сутки (n=157) и в группу терапии бозутинибом в дозировке 500 мг один раз в сутки (n=76).
Рисунок 1. Дизайн исследования ASCEMBL.
Примечания:
* Необходимо соответствие критериям отсутствия ответа на лечение согласно рекомендациям Европейской организации по лечению лейкозов 2013 года.
а. Негематологические токсические явления 3-й или 4-й степени тяжести на фоне лечения, стойкие токсические явления 2-й степени тяжести, не поддающиеся купированию стандартными мерами, в том числе посредством коррекции дозы, или гематологические токсические явления 3-й или 4-й степени тяжести на фоне лечения, сохраняющиеся после перехода на наименьшую рекомендуемую дозу.
b. Пациенты продолжат получать исследуемый препарат до 96 недель после введения первой дозы, полученной последним пациентом, или 48 недель до перехода последнего пациента на асциминиб (в зависимости от того, что случится позднее).
Результаты
Эффективность
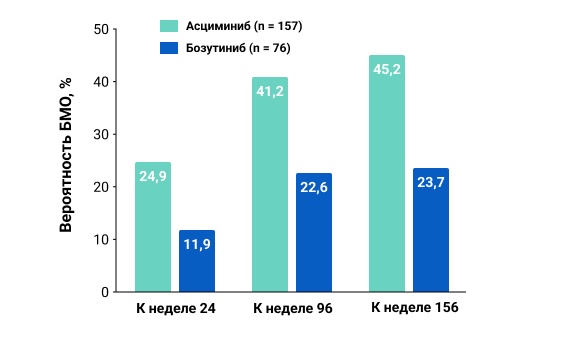
Согласно полученным результатам, терапия асциминибом продемонстрировала более высокую эффективность в сравнении с терапией бозутинибом. Оценка первичной конечной точки показала, что большой молекулярный ответ (БМО) достигался быстрее и оставался неизменно выше при применении асциминиба на 24-й, 96-й и 156-й неделях исследования. Так, частота достижения БМО составляла 24,9% в группе терапии асциминибом vs 11,9% в группе терапии бозутинибом, через 24 недели исследования; и 45,2% в группе терапии асциминибом vs 23,7% в группе терапии бозутинибом, через 56 недель (рис.2). Разница в совокупной частоте БМО между группами терапии стала очевидной уже на 12-й неделе наблюдения. Вероятность (95%ДИ) сохранения БМО в течение как минимум 120 недель составила 97,0% (88,6–99,2%) при применении асциминиба и 92,9% (59,1–99,0%) при применении бозутиниба, причем частота ответа была очень устойчивой.
Рисунок 2. Вероятность достижения БМО в группах терапии на 24-й, 96-й и 156-й неделе исследования.
Частота достижения уровня BCR::ABL1IS ≤ 1% также была выше в группе асциминиба на протяжении всего периода наблюдения (рис.3).
Рисунок 3. Частота достижения уровня BCR::ABL1IS ≤ 1 % в группах терапии на 24-й, 96-й и 156-й неделе исследования.
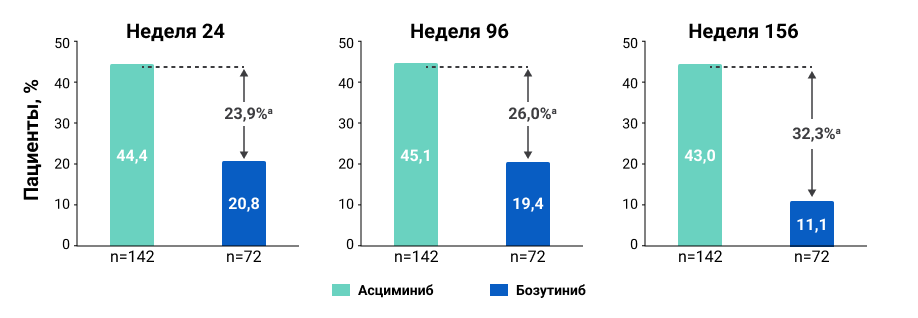
а. Разница в терапии после корректировки по статусу БЦО в начале исследования составила 23,92% (95% ДИ 11,36–36,49%) на 24-й неделе, 26,02% (95% ДИ 13,48–38,56%) на 96-й неделе и 32,34% (95% ДИ 21,44–43,24%) на 156-й неделе.
Совокупная частота достижения уровня BCR::ABL1IS ≤ 1% продолжала нарастать с течением времени в группе применения асциминиба, и к 156-й неделе не поддавалась оценке для бозутиниба. Частота достижения полного цитогенетического ответа (ПЦО) составляла в группе терапии асциминибом 40,8%, а в группе терапии бозутинибом 24,2% к 24 недели исследования, также оставаясь выше не протяжении всего периода наблюдения (рис.4).
Рисунок 4. Частота достижения ПЦО в группах терапии.
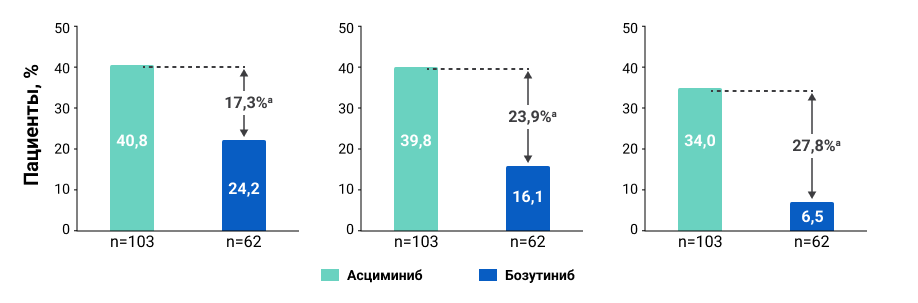
а. Оценка ПЦО обычно не проводится после 96-й недели, и некоторые пациенты могли пропустить оценку.
Выживаемость без прогрессирования (ВБП) через 3 года и общая выживаемость (ОВ) через 5 лет были сходными в группах применения асциминиба и бозутиниба (рис.5).
Рисунок 5. Выживаемость без прогрессирования через 3 года и общая выживаемость через 5 лет.
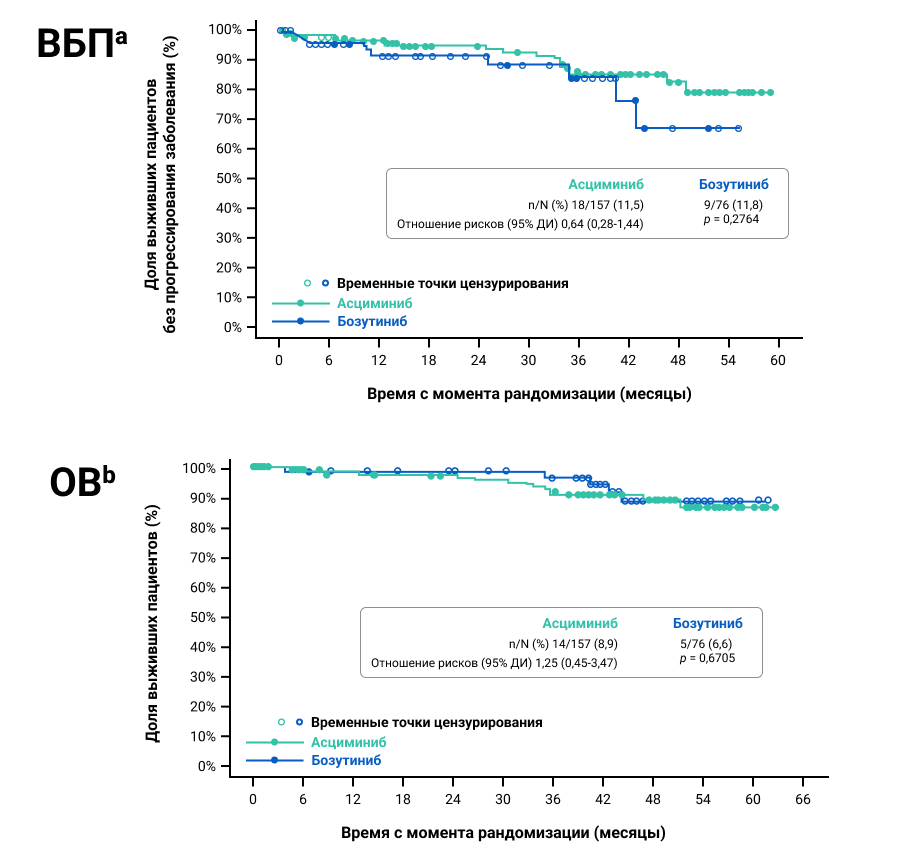
a. На основании данных 103 из 157 пациентов, получавших асциминиб, и 62 из 76 пациентов, получавших бозутиниб, не имевших ПЦО в начале исследования. Если в конкретную дату достоверные цитогенетические оценки отсутствовали, данные о ПЦО подставляли на основании БМО.
b. Разница в лечении после корректировки по исходному статусу БЦО составила 17,30% (95% ДИ 3,62–30,99%) на 24-й неделе, 23,87% (95% ДИ 10,30–37,43%) на 96-й неделе и 27,84% (95% ДИ 16,63–39,06%) на 144-й неделе.
Безопасность/переносимость
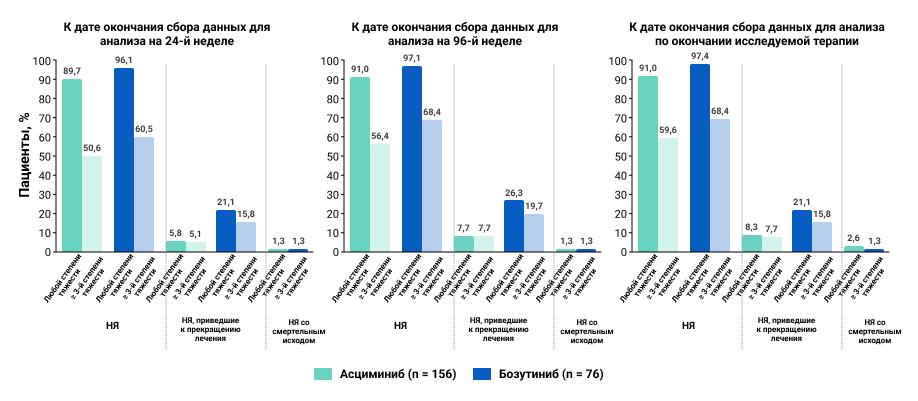
Асциминиб демонстрировал благоприятный профиль безопасности и переносимости на протяжении всего исследования. С момента проведения предыдущих анализов новых или ухудшающихся данных по безопасности не выявлено. Количество нежелательных явления (НЯ), приведших к прекращению лечения, было в ≥ 3 раз выше на фоне терапии бозутинибом (27,6%), в сравнении с асциминибом (8,3%) (рис.6).
Рисунок 6. НЯ любой степени тяжести в обеих группах терапии.
Тромбоцитопения была наиболее частым НЯ, приведшим к прекращению лечения на фоне терапии асциминибом, в то время как нейтропения, повышение уровня АЛТ, диарея и плевральный выпот на фоне терапии бозутинибом (табл.1).
Таблица 1. Наиболее частые нежелательные явления в обеих группах.

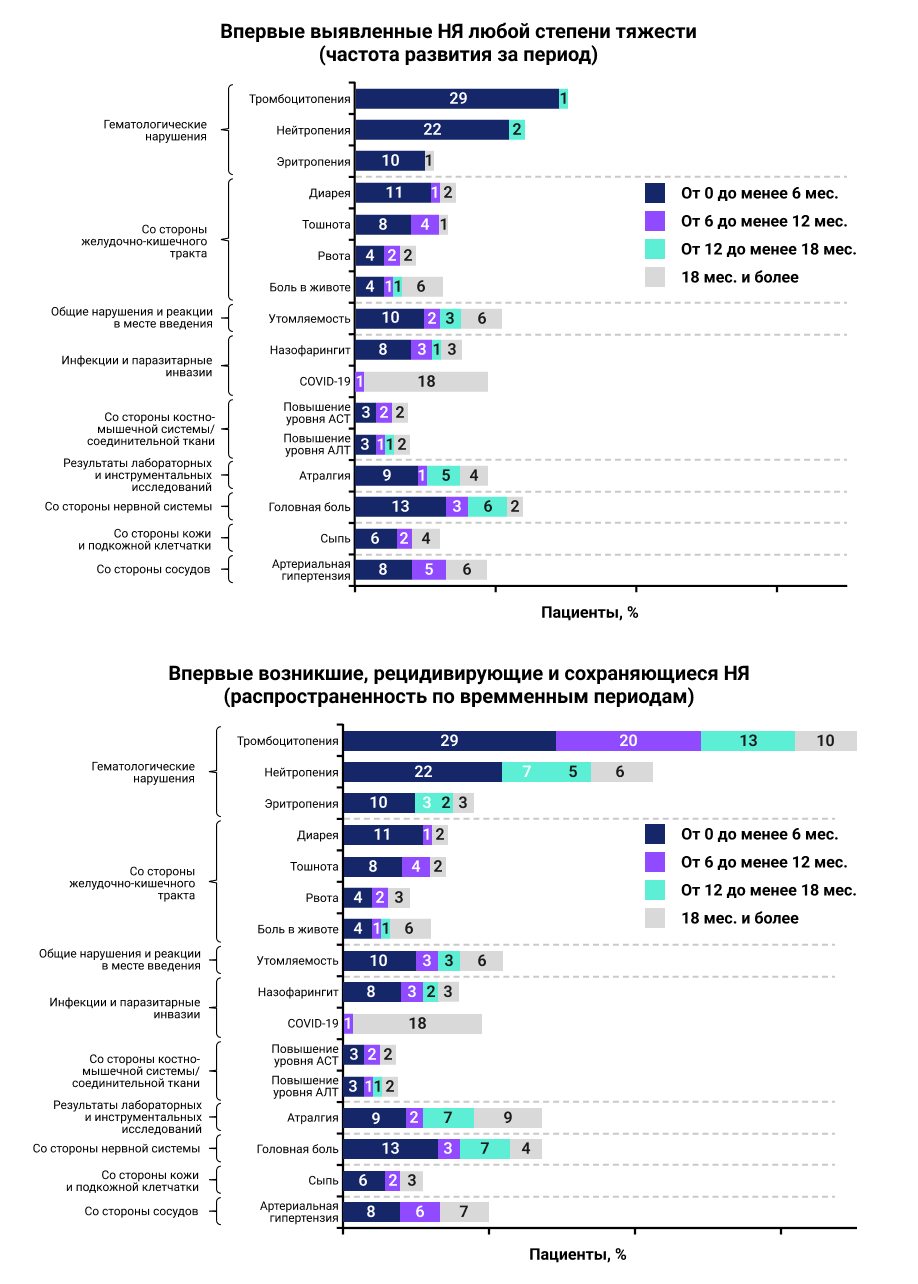
НЯ любой степени тяжести были зарегистрированы у 91,0% и 97,4% пациентов, получавших асциминиб и бозутиниб соответственно. Большинство НЯ возникали в течение первых 6 месяцев терапии асциминибом и были редкими после 6 месяцев лечения (рис.8).
Рисунок 8. Динамика показателей нежелательных явлений.
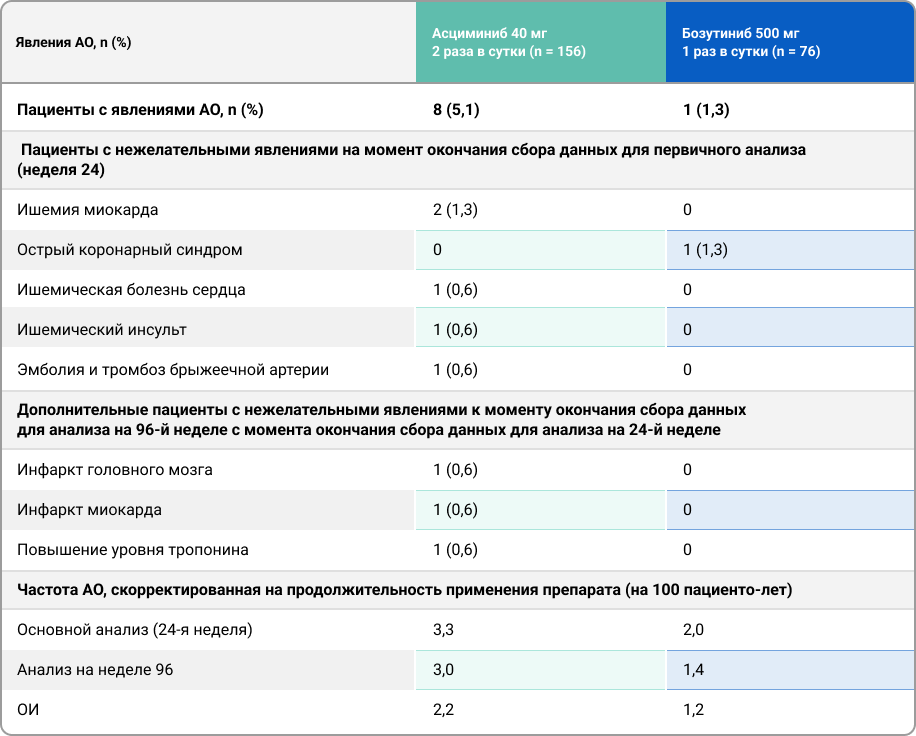
Не отмечалось увеличения риска развития явлений артериальной оклюзии (АО) на фоне применения асциминиба (табл.2). При этом, из 8 пациентов с явлениями АО в группе применения асциминиба, 7 ранее получали нилотиниб, 6-дазатиниб, 3-понатиниб. Практически все пациенты на момент скрининга имели факторы риска развития ССЗ.
Таблица 2. Анализ частоты явлений артериальной окклюзии.
Из 28 пациентов, прекративших прием бозутиниба по причине отсутствия эффективности, 25 пациентов были переключены на терапию асциминибом. Большинство из них ранее получали 4 и более ИТК, и все, за исключением 1 пациента, имели исходный уровень BCR:ABL1IS > 10% до смены терапии. Никто из пациентов этой когорты не достиг БМО к 48 неделе после переключения. Однако, у 24% пациентов к 48 неделе был зафиксирован уровень BCR:ABL1IS ≤10%, а 8% достигли уровня BCR: ABL1IS ≤1%. Профиль безопасности асциминиба в когорте пациентов после переключения соответствовал профилю безопасности в основной исследуемой популяции. Наиболее частыми (≥10%) НЯ ≥3 степени были нейтропения (32,0%) и тромбоцитопения (24,0%). НЯ, приводящие к прекращению терапии, были зарегистрированы у 8,0% пациентов.
Выводы
В течение 4 лет наблюдения асциминиб продолжал демонстрировать устойчивую более высокую эффективность в сравнении с бозутинибом у пациентов с ХМЛ-ХФ, получавших ранее как минимум 2 ИТК.
Асциминиб продемонстрировал благоприятный профиль безопасности, при этом с момента проведения первичного анализа новых сигналов безопасности выявлено не было.
Риск развития явлений АО оставался стабильным при применении асциминиба и не возрастал при более длительном применении.
В когорте пациентов, сменивших терапию, ответ был неудовлетворительным, что, возможно, связано с поздним назначением асциминиба, серьезной предлеченностью пациентов и/или высоким уровнем BCR:ABL1IS на старте исследования. Этот результат подкрепляет рекомендации по назначению асциминиба уже на ранних этапах терапии ХМЛ-ХФ.
Результаты исследования ASCEMBL убедительно демонстрируют целесообразность и эффективность применения асциминиба в качестве терапии выбора по сравнению с бозутинибом у пациентов с неоптимальным ответом и/или непереносимостью как минимум двух ранее использованных ИТК, что позволяет большему числу пациентов достичь целей терапии без необходимости смены препарата.
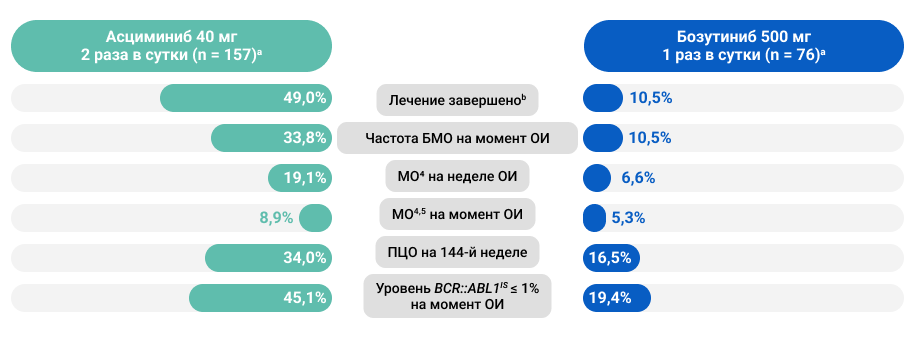
Рисунок 5. Эффективность и безопасность в исследовании III фазы ASCEMBL на момент окончания исследования: резюме.
a. Медиана продолжительности периода последующего наблюдения составила 2,3 года.
b. На момент окончания сбора данных (6 октября 2021 г.).
Список литературы
- Hochhaus A, Réa D, Boquimpani C, Minami Y, Cortes JE, Hughes TP, Mauro MJ et al. Asciminib vs bosutinib in chronic-phase chronic myeloid leukemia previously treated with at least two tyrosine kinase inhibitors: longer-term follow-up of ASCEMBL. Leukemia. 2023 Mar;37(3):617–626. doi: 10.1038/s41375–023–01829–9. Epub 2023 Jan 30. PMID: 36717654; PMCID: PMC9991909.
- Rea D, et al. Oral presentation at: 2022 ASCO Annual Meeting; June 3–7, 2022; Chicago, IL, and virtual. Abstract 7004.
- Rea D, et al. Oral presentation at: EHA 2022; June 9–17, 2022; Vienna, Austria. Abstract S155.
- Mauro MJ, et al. Presented at 65th ASH Annual Meeting & Exposition; December 9–12, 2023; San Diego, California & virtual. Abstract 4536.
- Baccarani M, Deininger MW, Rosti G, Hochhaus A, Soverini S, Apperley JF, et al. European LeukemiaNet recommendations for the management of chronic myeloid leukemia: 2013. Blood. 2013;122:872–84. doi: 10.1182/blood-2013–05–501569.
11342354/ASC/DIG/01.25/0