GEMFIN
Цель исследования: сравнение общей выживаемости и частоты тромботических осложнений у больных истинной полицитемией (ИП) с резистентностью или непереносимостью гидроксикарбамида в группах руксолитиниба и наилучшей доступной терапии (НДТ).
Ключевые выводы исследования1:
У больных ИП с резистентностью или непереносимостью гидроксикарбамида, получавших руксолитиниб в исследовании RESPONSE, риск развития тромбоза и смертельного исхода был значительно ниже по сравнению с ретроспективной когортой пациентов, получавших НДТ в исследовании GEMFIN (рис. 1, 2).
Таблица 1 — Дизайн исследования GEMFIN
 |
 |
 |
 |
| Группы сравнения (анализируемые группы руксолитиниба и НДТ (n = 89 и 92 в каждой когорте) были сопоставимы) | Клиническое исследование III фазы RESPONSE | Сравнительный анализ | Рутинная клиническая практика, регистр Grupo Español de Enfermedades Mieloproliferativas Crónicas Filadelfia Negativas (GEMFIN) |
| Число больных | n = 110 | n = 191 | |
| Лечение | Руксолитиниб |
НДТ: гидроксикарбамид (44%), бусульфан (10%), радиоактивный фосфор (2%), интерферон (6%), анагрелид (12%), другие лекарственные средства (11%), наблюдение (26%) |
Результаты исследования

Примечание.
ОР — отношение рисков.
Рисунок 1. Общая выживаемость на сопоставимых группах больных ИП с резистентностью или непереносимостью гидроксикарбамида на терапии руксолитинибом лучше в сравнении с НДТ (метод Каплана–Мейера)1
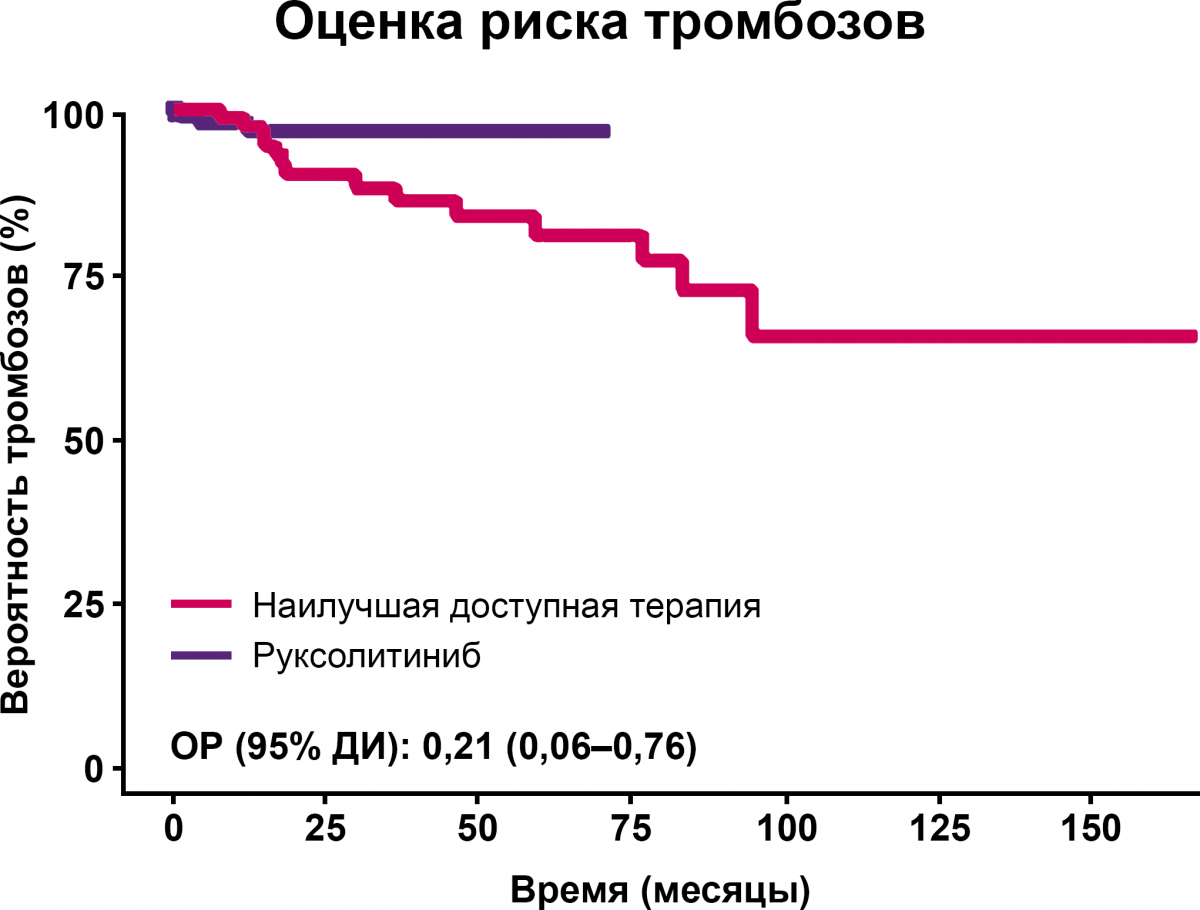
Примечание.
ОР — отношение рисков.
Рисунок 2. Риск тромбоза на сопоставимых группах больных ИП с резистентностью или непереносимостью гидроксикарбамида на терапии руксолитинибом ниже в сравнении с НДТ (метод Каплана–Мейера)1
Исследование безопасности руксолитиниба у больных миелофиброзом (первичный миелофиброз, постполицитемический миелофиброз, посттромбоцитемический миелофиброз)
Пострегистрационное клиническое исследование руксолитиниба проводится в целях дополнительного сбора данных о безопасности и эффективности, расширения показаний к применению, а также выявления нежелательных явлений2.
-
проспективное;
-
многоцентровое;
-
наблюдательное;
-
неинтервенционное.
Пациенты были сгруппированы по принципу терапии исследуемым препаратом: менее 6 месяцев (181 пациент), более 6 месяцев (79), руксолитиниб как первая линия терапии (32), не получающие руксолитиниб на момент включения в исследование (170), принимают руксолитиниб по решению исследователя (57).
Ключевые выводы исследования2:
-
Долгосрочная безопасность руксолитиниба у больных миелофиброзом соответствовала предыдущим исследованиям.
-
Не было выявлено никаких новых или неожиданных нежелательных явлений.
-
Наблюдаемый профиль безопасности подтверждает возможность длительной терапии руксолитинибом как у пациентов с миелофиброзом, группы промежуточный-2 и высокий риск, так и у больных пожилого возраста и пациентов группы промежуточный-1 риск.
Результаты исследования2
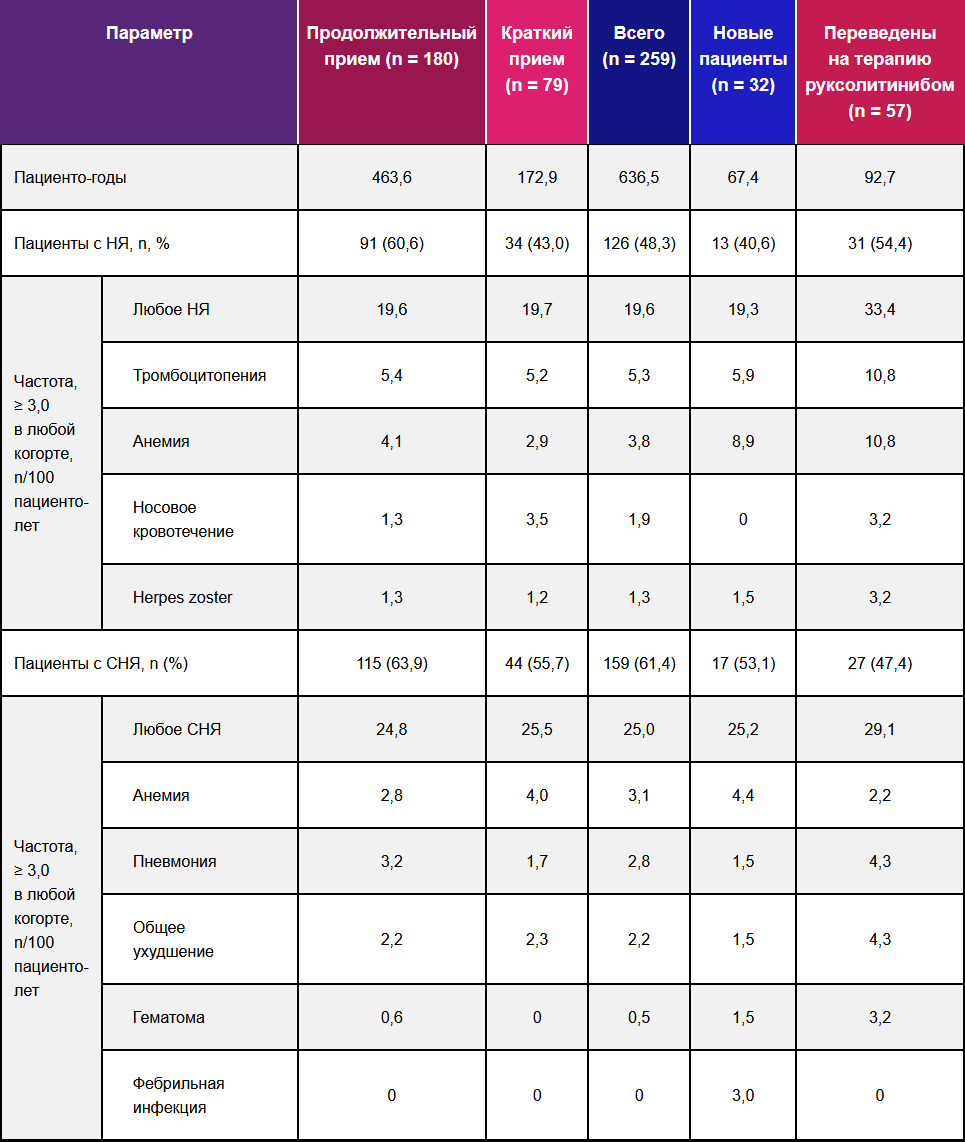
Результаты исследования представлены в табл. 2, 3.
Таблица 2 — Характеристики лечения и дозы
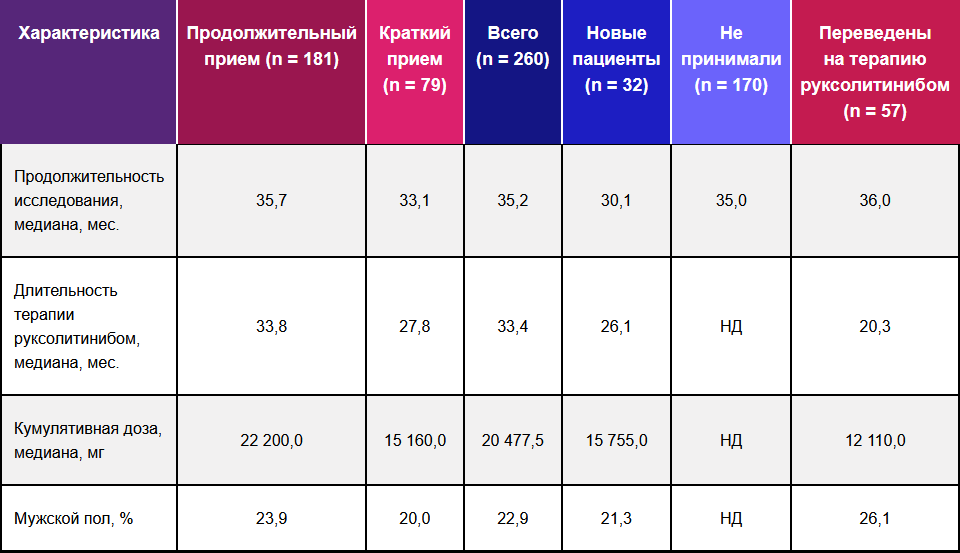
Таблица 3 — Нежелательные явления, связанные с приемом препарата
PALANDRI
Исследование проведено с целью оценки значимости сокращения размера селезенки во время терапии руксолитинибом3.
Ключевые выводы исследования:
Терапия руксолитинибом более эффективна у пациентов с ранними стадиями миелофиброза.
Конечная точка:
корреляция между размером селезенки и ответом на терапию.
Характеристика пациентов

Таблица 4 — Дизайн исследования PALANDRI
 |
 |
 |
 |
| Группы сравнения | Пациенты со стабильным ответом | Пациенты без ответа | |
| ОР 0,45 95% ДИ 0,25–0,82, p = 0,01 | Группа низкого риска, промежуточного-1 DIPSS | Многофакторный анализ | Группа высокого риска |
| ОР 0,24 95% ДИ 0,11–0,55, p = 0,001 | Нет массивной спленомегалии (более 10 см из-под края реберной дуги) | Массивная спленомегалия | |
| ОР 0,51 95% ДИ 0,27–0,98, p = 0,04 | Раннее начало терапии руксолитинибом (2 года после установления диагноза) | Позднее начало терапии руксолитинибом | |
| ОР 1,98 95% ДИ 1,08–3,65, p = 0,03 | Высокие дозы руксолитиниба (≥ 15 мг × 2 раза в день) | Невысокие дозы руксолитиниба |
Результаты исследования
Лучший ответ на терапию, лучшая общая выживаемость получены у больных ранними стадиями в сравнении с продвинутыми стадиями миелофиброза (рис. 3).


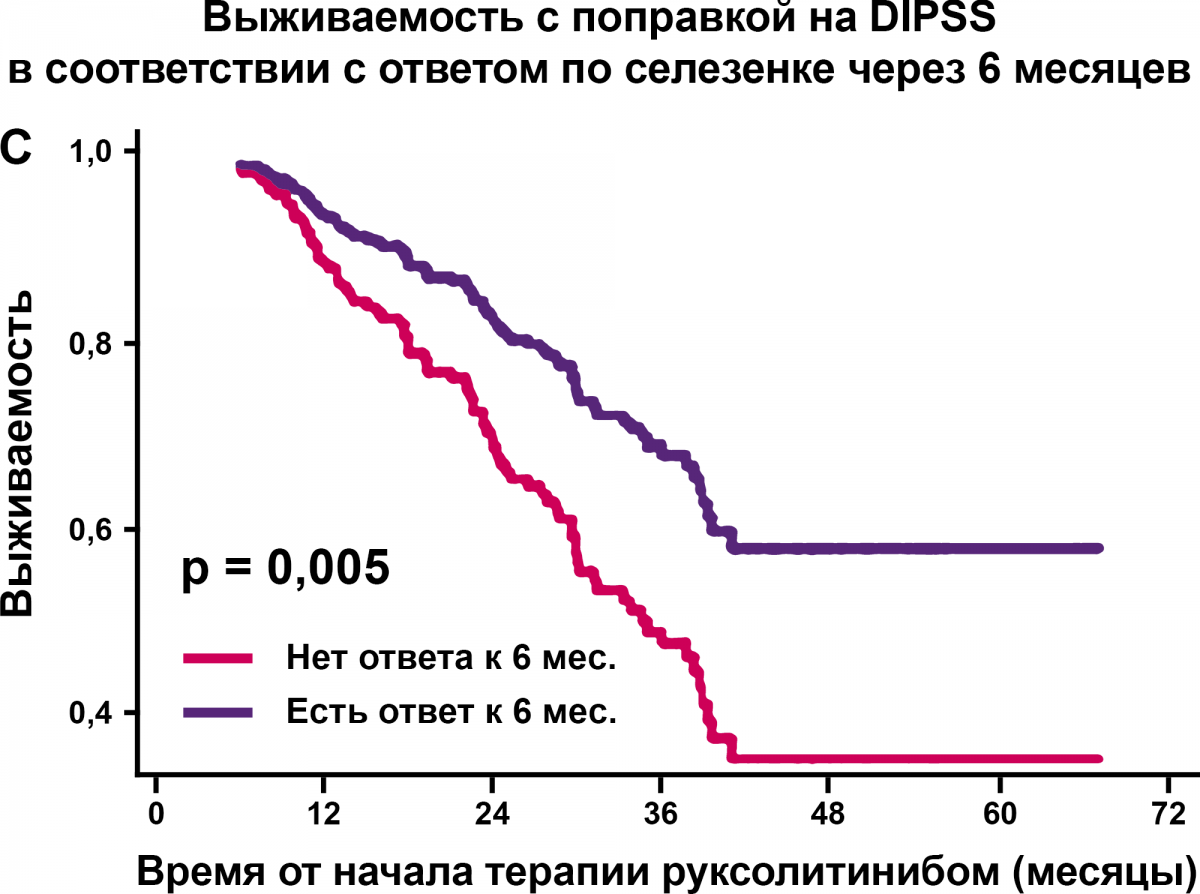



Рисунок 3. Результаты исследования PALANDRI
REALISE
Исследование по оценке безопасности и эффективности альтернативного режима дозирования руксолитиниба у пациентов с миелофиброзом и анемией (гемоглобин < 100 г/л): начальная доза 10 мг дважды в день в течение 12 недель с постепенным повышением суточной дозировки4.
Ключевые выводы исследования:
-
Руксолитиниб эффективен в отношении сокращения размера селезенки независимо от уровня гемоглобина и трансфузионной зависимости.
-
Терапия руксолитинибом позволяет купировать конституциональные симптомы.
-
Приемлемый профиль безопасности.
Результаты исследования4
Сокращение размеров селезенки к 24-й неделе терапии руксолитинибом с редукцией дозировки наблюдалось в большинстве случаев (табл. 5).
Таблица 5 — Сокращение размеров селезенки к 24-й неделе терапии
| Сокращение размеров селезенки ≥ 50% | 63,6% (28/44) |
| Сокращение размеров от 25 до 50% | 11,4% (5/44) |
Сокращение размеров селезенки к 24-й неделе терапии руксолитинибом с редукцией дозировки наблюдалось независимо от трансфузионного статуса (табл. 6).
Таблица 6 — Сокращение размеров селезенки к 24-й неделе терапии
| Сокращение размеров селезенки ≥ 50% | Трансфузионно-зависимые пациенты | 75,0% (6/8) |
| Сокращение размеров от 25 до 50% | Трансфузионно-независимые пациенты | 70,8% (17/24) |
Коррекция дозировки руксолитиниба4:
-
на 12-й неделе у 10 пациентов доза увеличена до 15 мг дважды в день;
-
у 23 пациентов было снижение дозы ≥ 1 или перерыв в терапии, чаще всего из-за НЯ (n = 13).
Улучшение симптомов опухолевой интоксикации на ≥ 50% по сравнению с исходным уровнем отмечалось у 51,1% пациентов4.
Ретроспективно проведено секвенирование следующего поколения (NGS) с использованием панели 236 генов. Данные NGS‑анализа доступны для 49/51 пациента.
Тип драйверной мутации (JAK2 (n = 33), CALR (n = 11) и MPL (n = 7)) или тройной негативный вариант (n = 2) не оказывал влияния на ответ на лечение руксолитинибом.
Наиболее часто встречающиеся мутации4.
-
TET2, ASXL1, U2AF1 и SRSF2 у пациентов с сокращением размера селезенки на ≥ 50% к 24-й неделе (n = 28);
-
TP53, FAT1 и ASXL1 у больных, не отвечающих на лечение.
Среднее количество мутаций у одного пациента было 2 (диапазон 1–7).
Выявлено ≥ 3 мутаций:
-
у 35,7% (10/28) пациентов с ответом на проводимую терапию;
-
у 14,3% (3/21) пациентов, не ответивших на лечение.
Мутационный статус не оказывал влияния на ответ со стороны селезенки, наличия конституциональных симптомов.
Тем не менее была более высокая частота мутации U2AF1 у пациентов, которые изначально были трансфузионно зависимы, по сравнению с пациентами, не зависимыми от переливаний (4/8 (50%) против 3/41 (7,3%) соответственно).
Мутация TP53 выявлена у 6 пациентов. В 5 случаях не было ответа на лечение. Ни один из этих 5 пациентов не завершил 24‑недельный курс лечения, и 3 пациента умерли в течение периода исследования или наблюдения5,6.

Рисунок 4. Наиболее частые соматические мутации с вероятным/известным значением
Таблица 7 — Наиболее часто встречающиеся дополнительные молекулярные события и их клиническая значимость
| Наиболее частые недрайверные мутации | ||
| Ответившие на лечение | Нет ответа на лечение | |
| Уменьшение длины селезенки на 50% к 24-й неделе |
ASXL1 (6/28) TET2 (6/28) U2AF1 (5/28) SRSF2 (5/28) |
TP53 (5/21) FAT1 (4/21) ASXL1 (3/21) |
| PRO (MF-7) снижение симптомов на 50% на 24-й неделе |
ASXL1 (4/22) TET2 (4/22) U2AF1 (4/22) CIC (4/22) |
TP53 (5/21) ASXL1 (5/21) SRSF2 (4/21) TET2 (4/22) |
| PRO (MFSAF v.2.0) снижение симптомов на 50% к 24-й неделе |
ASXL1 (4/24) U2AF1 (4/24) TET2 (4/24) CIC (4/24) |
TP53 (6/19) ASXL1 (5/19) SRSF2 (4/19) TET2 (4/19) |
| Зависит от переливания крови | Не зависит от переливания крови | |
| Переливание крови исходно |
U2AF1 (4/8) ASXL1 (3/8) |
ASXL1 (6/41) TET2 (6/41) SRSF2 (6/41) TP53 (5/41) |
Безопасность руксолитиниба в исследовании REALISE
Гематологические НЯ степени 3/4:
-
анемия (27,5%);
-
тромбоцитопения (13,7%).
Негематологические НЯ, встречающиеся у > 10% пациентов:
-
утомляемость (11,8%).
LANDMARK
Исследование проведено с целями:
-
оценка понимания диагноза врачами и пациентами;
-
сравнение восприятия симптомов врачами и пациентами и осведомленности об имеющихся методах лечения;
-
определение степени осознания пациентами симптомов заболевания, функциональных возможностей и потребности в скорейшем начале лечения;
-
выявление возможного расхождения представлений врачей и пациентов о возможностях лечения.
Ключевые выводы:
Исследование выявило разногласия в представлении о МПН между пациентами и врачами, что свидетельствует о необходимости улучшения коммуникации. Использование опросника MPN-10 должно решить данную проблему7,8.
Характеристика участников исследования
В исследование было включено 506 пациентов:
-
ПМФ — 147, ИП — 168, ЭТ — 191;
-
соотношение женщин и мужчин — 1:1 (52%:48%);
-
средний возраст пациентов составил 60,0 ± 10,69 года;
-
большинство пациентов испытывали симптомы в течение ≤ 1 года до постановки диагноза МПН (83%).
В исследовании принимали участие 240 врачей:
-
68% гематологов, 32% онкологов;
-
36% врачей использовали утвержденную форму оценки симптомов;
-
39% использовали свой собственный метод.
Результаты исследования
Результаты исследования представлены на рис. 5.
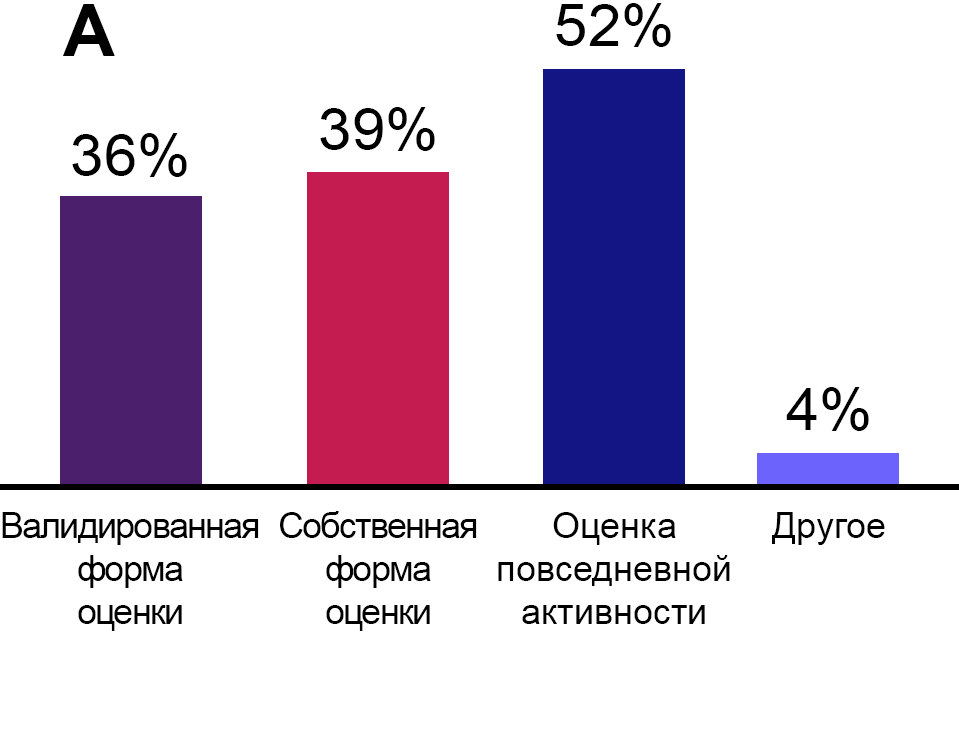

Рисунок 5. (А) Инструменты или подходы, используемые врачами для оценки симптомов у больных МПН.
(В) Ответ пациентов на вопрос: «Как врач оценивает симптомы МПН»
Многие пациенты не осознавали, что их симптомы могут быть связаны с МПЗ (рис. 6).

Рисунок 6. Ответы врачей об осведомленности пациентов о симптомах МПН
Восприятие значимости симптомов МПН врачами и пациентами:
-
Усталость/утомляемость были одним из наиболее часто зарегистрированных врачами симптомов: 69% при ПМФ, 40% при ИП, 54% при ЭТ.
-
Многие пациенты не связывали, что данные симптомы являются следствием МПН: 18% при ПМФ, 25% при ИП, 18% при ЭТ.
-
43% врачей указали, что пациенты могли идентифицировать только некоторые из их симптомов как связанные с МПН.
Большая часть участников — 94% врачей и 82% пациентов считают, что симптомы МПЗ снижают качество жизни. 83% врачей сообщили, что даже умеренные симптомы могут оказывать негативное влияние на качество жизни пациентов.
Наряду с высокой распространенностью конституциональных симптомов пациенты сообщили о значительной эмоциональной нагрузке, связанной с их заболеванием: 78% при ПМФ, 59% — ИП, 57% — ЭТ.
Восприятие значимости симптомов МПН врачами и пациентами:



Рисунок 7. Цели лечения МПН по мнению врачей и пациентов
Удовлетворенность общением и восприятием целей:
-
28% врачей отметили полное согласие со своими пациентами в отношении целей лечения.
-
25% пациентов были недовольны пониманием со стороны врача и поддержкой их целей лечения. Пациенты сообщали, что чувствуют себя хуже, чем врач оценивает их состояние (62% больных ПМФ; 42% ИП; 47% ЭТ).

Рисунок 8. Удовлетворенность общением относительно МПН и целей лечения врачами (А) и пациентами (В)
ROBUST
В многоцентровое открытое исследование фазы II были включены 48 пациентов в возрасте старше 18 лет с первичным миелофиброзом (ПМФ) с пост-истинной полицитемией (ИП) МФ и пост-ЭТ (эссенциальной тромбоцитемией) МФ высокого риска, промежуточного риска-2 и промежуточного риска-19.

В зависимости от уровня тромбоцитов пациенты получали руксолитиниб в дозе 15 мг 2 р/сут (100–200 × 109/л) или 20 мг 2 р/сут (> 200 × 109/л). При недостаточном ответе допускалось повышение дозы. Снижение дозировок или прекращение приема возможно было при развитии серьезных нежелательных явлений1.
Конечные точки9
Первичной комбинированной конечной точкой являлась эффективность терапии, определявшаяся в качестве пропорции пациентов с уменьшением длины селезенки на ≥ 50% и/или уменьшением на ≥ 50% числа баллов по 7-d модифицированной шкале MF-SAF TSS на неделе 48.
Качество жизни оценивалось с помощью формы оценки симптомов МФ (MAF SAF) исходно и на неделях 4, 12, 24 и 48.
Безопасность и переносимость терапии оценивались посредством мониторинга частоты, длительности и тяжести НЯ.
Результаты исследования9
Эффективность
На неделе 48 половина пациентов достигла успеха в лечении по первичной комбинированной конечной точке. Из них 51,7% составили пациенты риска ПРОМ-1, 38,5% — риска ПРОМ-2 и 52,4% — высокого риска. Статистической разницы между группами не наблюдалось (p = 0,599) (рис. 9)9.

Рисунок 9. Средняя длина селезенки, см
Снижение длины селезенки на ≥ 50% на неделе 48 было достигнуто у 39,6% пациентов (95% ДИ 25,8–54,7) из всей популяции и 50,0%, 15,4% и 47,6% пациентов с ПРОМ-1, ПРОМ-2 и высокого риска соответственно(рис. 10).

Рисунок 10. Изменение длины селезенки
Улучшение качества жизни ≥ 50% по шкале MF-SAF TSS на неделе 48 было достигнуто у 20,8% пациентов в общей популяции, и в одинаковых пропорциях в каждой из групп ПРОМ-1 — 21,4%, ПРОМ-2 — 23,1%, высокого риска — 19,0% (рис. 11).

Рисунок 11. TSS при последнем посещении. Данные представлены для пациентов с ПРОМ-1 риском (n = 10), ПРОМ-2 риском (n = 11), высоким риском (n = 18)
На неделе 48 средний показатель по шкале MF-SAF TSS во всей популяции снизился с 15,4 до 7,6 (рис. 12)9.

Рисунок 12. Среднее изменение от исходного в показалеле MF-SAF TSS
Безопасность9
Наиболее частыми гематологическими НЯ являлись:
-
Анемия — 45,8%
-
Тромбоцитопения — 37,5%
Наиболее частыми негематологическими НЯ являлись:
-
Боль в животе — 27,1%
-
Носовое кровотечение — 27,1%
-
Диарея — 25%
-
Ушибы — 22,9%
-
Слабость — 22,9%
-
Головная боль — 22,9%
-
Летаргия — 20,8%
JUMP10
В открытое глобальное исследование IIIb фазы с расширенным доступом были включены 1144 пациента с первичным и вторичным МФ в возрасте ≥ 18 лет с высоким, ПРОМ-1, ПРОМ-2 риском по IPSS.
Начальные дозы руксолитиниба подбирались на основании исходного числа тромбоцитов: 5 мг 2 р/сут (50 × 109/л до < 100 × 109/л), 15 мг 2 р/сут (100–200 × 109/л) или 20 мг 2 р/сут (> 200 × 109/л ). При недостаточной эффективности дозы могли быть повышены до 25 мг 2 р/cут при адекватных уровнях тромбоцитов и нейтрофилов. Согласно протоколу исследования, при развитии серьезных нежелательных явлений дозы препарата могли быть снижены или временно отменены.
Первичная конечная точка10
Первичной конечной точкой исследования являлись безопасность, переносимость, оценивавшиеся по частоте, продолжительности и тяжести НЯ.
Дополнительные конечные точки включали:
-
Процент пациентов со снижением пальпируемой длины селезенки на ≥ 50%;
-
Общее число баллов по шкалам FACT-Lym и FACIT;
-
Выживаемость без прогрессирования;
-
Выживаемость без трансформации в острый миелоидный лейкоз;
-
Общую выживаемость.
Результаты10
На неделях 24 и 48 снижения пальпируемой длины селезенки ≥ 50% достигли 56,9% и 62,3% пациентов соответственно. Уменьшение длины селезенки на ≥ 50% наблюдалось у большинства пациентов (69,0%) на неделе 48, а у 23% пациентов селезенка не пальпировалась. Пропорции пациентов, достигших снижения длины селезенки на ≥ 50%, на неделе 48 были сопоставимы у пациентов с первичным и вторичным МФ (66,9% vs 71,6% соответственно) (рис. 13).

Рисунок 13. Процент пациентов пациентов, достигших снижения длины селезенки
Безопасность10
Наиболее частыми гематологическими НЯ являлись:
-
Анемия любой степени (56,3%)
-
Тромбоцитопения любой степени (42,2%)
Серьезные нежелательные явления наблюдались у 32,3% пациентов.
Наиболее частые негематологические НЯ включали:
-
Диарею
-
Пирексию
-
Слабость
-
Астению
Нежелательные явления представлены в таблице 8.
Таблица 8 — Характеристика нежелательных явлений
| Нежелательное явление | Любой степени, n (%) | 3–4 степени, n (%) |
| Анемия | 644 (56,3) | 378 (33,0) |
| Тромбоцитопения | 483 (42,2) | 143 (12,5) |
| Нейтропения | 63 (5,5) | 44 (3,9) |
| Диарея | 166 (14,5) | 13 (1,1) |
| Пирексия | 152 (13,3) | 16 (1,4) |
| Слабость | 148 (12,9) | 15 (1,3) |
| Астения | 143 (12,5) | 18 (1,6) |
| Периферический отек | 105 (9,2) | 8 (0,7) |
| Головная боль | 105 (9,2) | 4 (0,3) |
| Диспноэ | 101 (8,8) | 22 (1,9) |
Список литературы:
- EHA 2018: Ruxolitinib Reduces Risk of Thrombosis, Death in Patients With Polycythemia Vera By The ASCO Post Posted: 6/20/2018 12:25:56 PM Last Updated: 6/20/2018 12:25:56 PM.
- Barraco F., Greil R., Herbrecht R. et al. REAL-WORLD SAFETY DATA FROM A NONINTERVENTIONAL LONG-TERM POSTAUTHORIZATION SAFETY STUDY OF RUXOLITINIB IN MYELOFIBROSIS. EHA Library. BARRACO F. 06/14/19; 266478; PF679.
- Latagliata L. et al. Urability of spleen response affects the outcome of ruxolitinib-treated patients with myelofibrosis: Results from a multicentre study on 284 patients. Leukemia Research 2018, Volume 74, 86-88.
- F. Cervantes et al. SAFETY AND EFFICACY OF RUXOLITINIB (RUX) IN PATIENTS WITH MYELOFIBROSIS (MF) AND ANEMIA (HB <10 G/DL): RESULTS AT WEEK (WK) 24 OF THE REALISE TRIAL. EHA Library. Cervantes F. 06/15/19; 267082; PS1465.
- Li B. et al. Genes Chromosomes Cancer.2018.
- H.K. Al-Ali et al. Baseline Mutational Status of Patients with Myelofibrosis and Anemia in the Realise Trial and Impact on Outcome. Blood (2019) 134 (Supplement_1): 2952. https://doi.org/10.1182/blood-2019-124739
- R. Mesa et al. Myeloproliferative neoplasms (MPNs) have a significant impact on patients' overall health and productivity: The MPN Landmark survey BMC Cancer 2016 16(1):167 DOI: 10.1186/s12885-016-2208-2
- Claire N. Harrison et al. The impact of myeloproliferative neoplasms (MPNs) on patient quality of life and productivity: results from the international MPN Landmark survey. Ann Hematol. 2017; 96(10): 1653–1665. doi: 10.1007/s00277-017-3082-y
- A. J. Mead et al. Response to ruxolitinib in patients with intermediate‐1–, intermediate‐2–, and high‐risk myelofibrosis: results of the UK ROBUST Trial. BJH. 2015 Volume170 (1): 29-39.
- H. Kathrin Al-Ali, M. Griesshammer, P. le Coutre et al. Safety and efficacy of ruxolitinib in an open-label, multicenter, single-arm phase 3b expanded-access study in patients with myelofibrosis: a snapshot of 1144 patients in the JUMP trial. Haematologica. 2016;101(9):1065-73. doi: 10.3324/haematol.2016.143677
732635/JAK/webpage/10.23/0


