Протеинурия является важным маркером заболевания почек, который несет важную диагностическую и прогностическую информацию. Диагностика протеинурии является важнейшим элементом обследования как при остром повреждении почек, так и у пациентов с хронической болезнью почек (ХБП). Зачастую это самый ранний маркер патологии клубочков, возникающий до снижения скорости клубочковой фильтрации (СКФ). Уровень протеинурии используется для прогнозирования рисков прогрессирования ХБП, сердечно-сосудистых заболеваний и смертности от всех причин в общей популяции1, а также у пациентов с диабетом2 и ХБП3. Кроме того, протеинурия, играет важную роль в патогенезе поражения почек поражения, определяя прогрессирование патологии, а не просто является одним из маркеров заболевания4.
Распространенность протеинурии среди населения в целом составляет от 8% до 33%5-7. Cтойкая протеинурия у пациентов с факторами риска поражения почек составляет 15,3 на 1000 человеко-лет8. В США у 3,3% взрослого населения наблюдается стойкая альбуминурия с нормальной СК.
Пожалуйста, нажмите на интересующий вас раздел, чтобы его открыть.
Типы протеинурии
Различают следующие типы протеинурии10:
- Клубочковая протеинурия: возникает при увеличении проникновения белка через клубочковый барьер в случае потери заряда селективности или уменьшения размера селективности последнего. В отличие от других типов протеинурии, клубочковая протеинурия часто приводит к потере белка с мочой более 1 г в сутки.
- Канальцевая протеинурия: повреждение или дисфункция канальцев может снижать нормальную резорбтивную способность проксимального канальца, что в основном приводит к увеличению количества низкомолекулярных белков в моче. Канальцевая протеинурия чаще встречается в сочетании с клубочковой протеинурией. Классическими причинами изолированной канальцевой протеинурии являются синдром Фанкони и болезнь Дента.
- Протеинурия переполнения: избыточно синтезируемые нормальные или патологические белки плазмы крови, которые фильтруются в клубочке, не могут быть полностью реабсорбированы проксимальным канальцем, за счет чего они проникают в конечную мочу. Это происходит чаще с небольшими и (или) положительно заряженными белками и имеет клиническое значение, главным образом при патологии плазматических клеток (например, миеломе). Также это может происходить с миоглобином при рабдомиолизе и с гемоглобином при тяжелом внутрисосудистом гемолизе.
- Постренальная протеинурия: небольшие количества белка, обычно не альбумин (например, IgG или IgA), могут выделяться в мочевыводящие пути при их инфекции или мочекаменной болезни. При этом протеинурия сочетается с наличием лейкоцитов в мочевом осадке.
Нормальный уровень протеинурии
Как известно, в моче присутствуют две основные группы белков: плазменные белки (преимущественно альбумин), которые способны преодолевать фильтрационный барьер, и неплазменные белки — преимущественно белок Тамма-Хорсфалла, который образуется в почечных канальцах или мочевыводящих путях. В нормальных физиологических условиях около половины выделяемого белка составляет белок Тамма-Хорсфалла, кроме того, в сутки может экскретироваться менее 30 мг альбумина11. При нормальных уровнях протеинурии потери альбумина составляют приблизительно 20% от общего белка сыворотки крови. По мере увеличения протеинурии альбумин становится наиболее значимым и единственным присутствующим белком в моче12.
KDIGO
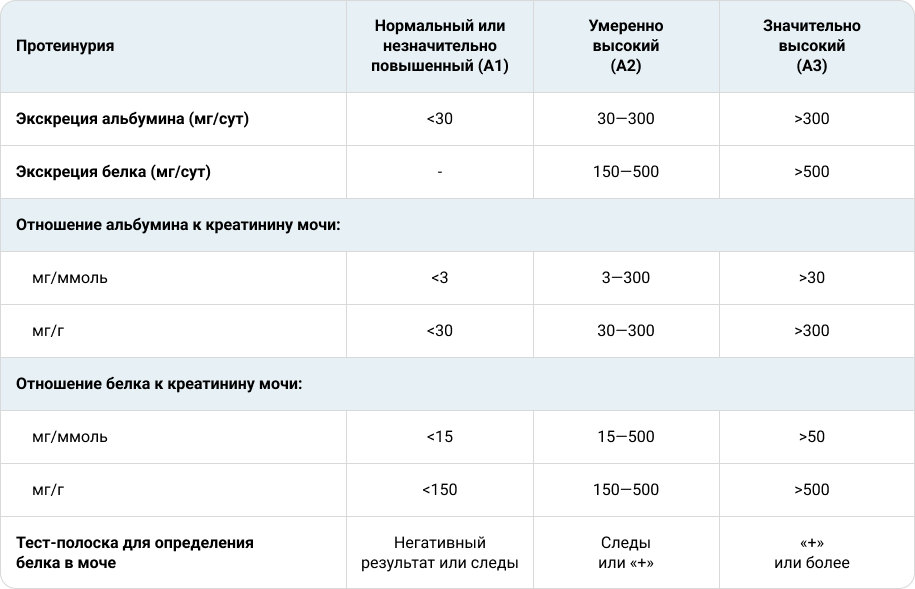
Согласно рекомендациям KDIGO (Kidney Disease: Improving Global Outcomes — Инициатива по улучшению глобальных исходов заболеваний почек) уровень протеинурии подразделяется на нормальный или незначительно повышенный, умеренно высокий и значительно высокий (см. таблицу 1). Вместе с тем прогрессирование заболеваний почек безусловно определяется по скорости снижения почечной функции. Так, свидетельством прогрессирования ХБП является снижение СКФ на 25+% от исходного уровня или более чем на 5 мл/мин/1,73 м2 в год13.
Таблица 1. Уровни протеинурии.
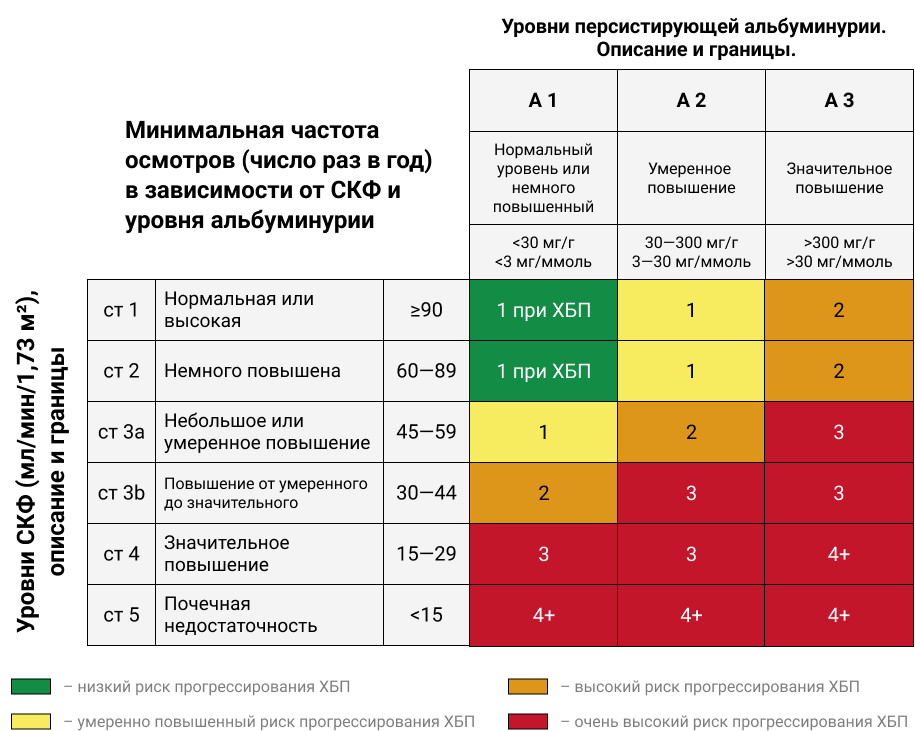
Стадии ХБП и частота ежегодных осмотров пациента также коррелируют с уровнем альбуминурии, относящейся к предикторам развития неблагоприятных сердечно-сосудистых событий14. Поэтому динамическое наблюдение за уровнем протеинурии может способствовать оценке эффективности проводимой терапии при ХБП.
Таблица 2. Классификация степени тяжести ХБП и определение тактики ведения пациентов.
Цифры в графах отражают показатели частоты мониторинга ХБП — обязательное число визитов к врачу в течение 1 календарного года. В желтой и оранжевой зоне — пациент может наблюдаться у терапевта. В красной зоне — обязательно наблюдение у нефролога.
Стойкая протеинурия приводит к снижению функции почек
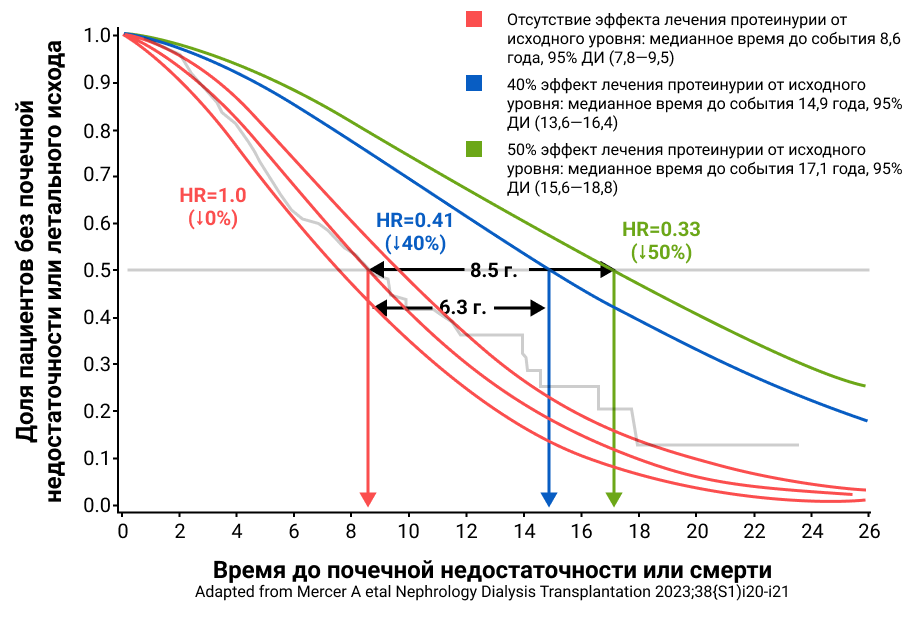
Взаимосвязь выраженности протеинурии с интенсивностью снижения СКФ доказана в ряде исследований. Так, анализ степени снижения протеинурии в связи с проводимым лечением продемонстрировал, что снижение протеинурии на 40% и 50% уменьшает риск почечной недостаточности/смерти на 59% и 67% соответственно, что, в свою очередь, приводит к увеличению среднего времени до наступления почечной недостаточности/смерти на 6,3 года и 8,5 лет соответственно. Пятилетняя выживаемость при этом увеличивается до 89% и 91% соответственно.
Рисунок 1. Кривая выживаемости Каплана-Мейера и анализ Вейбулла, оценивающие медианное время до почечной недостаточности/смерти для прогнозируемой почечной недостаточности.
Исследование в группе пациентов с IgA-нефропатией продемонстрировало, что высокие уровни протеинурии связаны с более выраженным снижением функции почек и более тяжелым интерстициальным фиброзом.
Например, пациенты с небольшой протеинурией или ее отсутствием (<0,5 г/день) имеют низкий риск прогрессирования заболевания, в то же время у пациентов с устойчивой протеинурией >3 г/сут скорость снижения функции почек увеличивается в 25 раз.
Данные исследований показали, что уровень протеинурии может служить предиктором риска повреждения почек и наступления терминальной почечной недостаточности в 10-летней перспективе15:
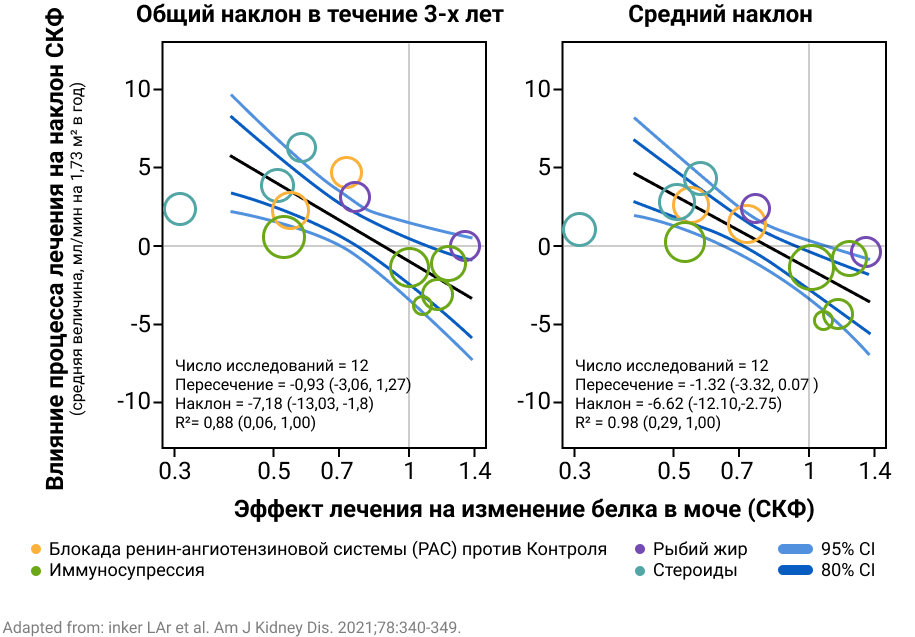
В метаанализе 12 клинических исследований с участием 1 037 пациентов с IgA-нефропатией установлено, что эффективное снижение протеинурии оказало положительное влияние на наклон кривой СКФ через 6 месяцев и 2 года, обеспечив снижение прогрессирования ХБП.
Рисунок 2. Cвязь между эффектами лечения на уровень белка в моче и наклоном СКФ.
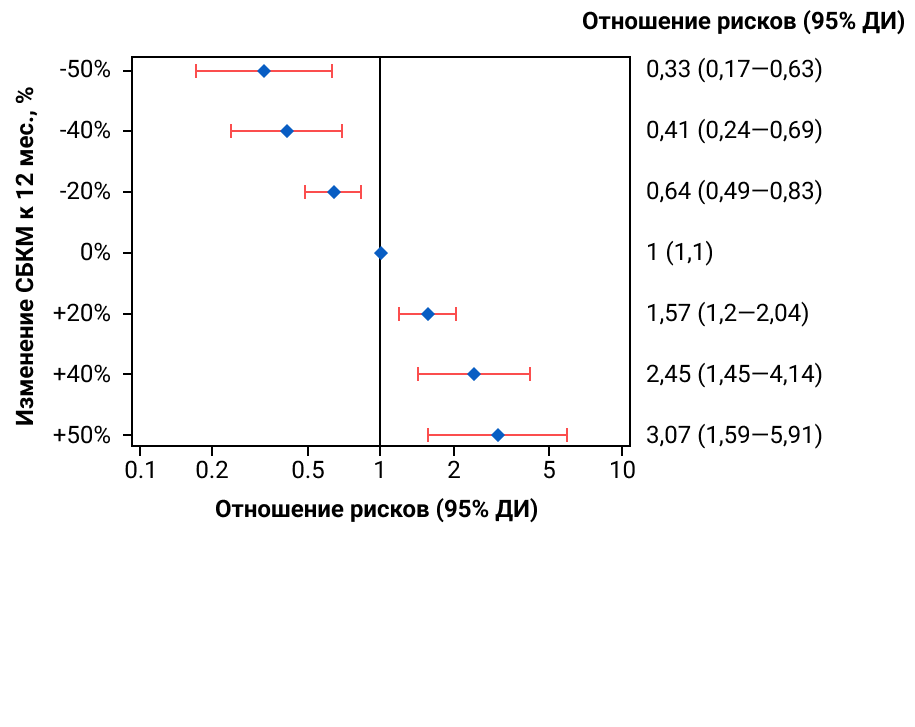
При длительном динамическом наблюдении 287 пациентов с С3-гломерулопатией и иммунокомплексным мембранопролиферативным гломерулонефритом (ИК МПГН), включенными в национальный реестр редких заболеваний почек Великобритании (RaDaR), было выявлено, что даже умеренное снижение протеинурии на 20—50% значительно уменьшает риск развития почечной недостаточности. Уменьшение отношения белка к креатинину мочи (СБКМ) на 40% в течение года приводит к более чем двукратному снижению риска развития почечной недостаточности у данной группы пациентов16.
Протеинурия как суррогатная точка в клинических исследованиях
Поиск новых препаратов, способных замедлить прогрессирование ХБП и снизить сопутствующие риски, затруднен особенностями проведения клинических исследований в нефрологии:
- Высокая распространенность маркеров почечной патологии (альбуминурии и стойкого снижения СКФ) в общей популяции, например у пациентов с сахарным диабетом II типа, артериальной гипертензией, избыточной массой тела, метаболическим синдромом.
- В клинических исследованиях с участием пациентов с острыми и хроническими поражениями почек затруднено использование плацебо, поскольку отсутствие эффективных методов лечения может приводить к необратимому прогрессированию заболевания почек.
- Реальные исходы заболевания (жесткие конечные точки) могут наступать через много лет после постановки диагноза, что удлиняет продолжительность наблюдения и ведет к длительному ожиданию результатов исследования. Кроме того, со временем нарастает риск развития и прогрессирования сопутствующей патологии, чаще сердечно-сосудистой, что ведет к необходимости дифференцировать причины клинических исходов в рамках исследования.
В связи с этим при проведении клинических испытаний для оценки эффективности терапии в нефрологии активно используют суррогатные конечные точки. Чаще всего это показатели, оценивающие степень выраженности поражения почек (альбуминурия/протеинурия, расчетная СКФ, уровень креатинина и клиренс эндогенного креатинина, артериальное давление (АД), уровень гемоглобина крови).
Такие конечные точки заменяют прямую оценку самочувствия или выживаемости пациента. Суррогатная точка предсказывает клиническую пользу или вред на основании полученных научных данных.
Протеинурия является достоверным маркером прогрессирования гломерулопатии и может использоваться для оценки эффективности проводимой терапии.
FDA и другие регулирующие органы признают снижение протеинурии в качестве допустимой конечной точки в исследованиях, оценивающих эффективность новых методов лечения ХБП и гломерулярных заболеваний17.
Эту позицию поддерживают результаты исследований, связывающие снижение протеинурии с улучшением функции почек и замедлением прогрессирования до терминальной стадии почечной недостаточности18.
В заключение следует отметить, что протеинурия является важным показателем для нефролога, выступая не только в качестве индикатора повреждения почек, но и в качестве суррогатной конечной точки в клинических исследованиях. Ее использование наряду со скоростью клубочковой фильтрации имеют решающее значение для оценки эффективности вмешательств и принятия клинических решений при лечении ХБП в целом и гломерулярных заболеваний в частности.
Список сокращений
- ХБП — хроническая болезнь почек;
- СКФ — скорость клубочковой фильтрации;
- США — Соединенные штаты Америки;
- IgG, IgА — иммуноглобулины типа G и типа А;
- KDIGO — Инициатива по улучшению глобальных исходов заболеваний почек (Kidney Disease: Improving Global Outcomes);
- RaDaR — национальный реестр редких заболеваний почек Великобритании;
- ИК МПГН — иммунокомплексный мембранопролиферативный гломерулонефрит;
- СБКМ — соотношение белка к креатинину мочи;
- АД — артериальное давление;
- FDA — Управление по контролю качества пищевых продуктов и лекарственных средств США (Food and Drug Administration).
Источники
- Kannel WB, Stampfer MJ, Castelli WP, et al. The prognostic significance of proteinuria: the Framingham study. Am Heart J. 1984;108(5):1347–1352.
- Ninomiya T, Perkovic V, de Galan BE, et al. Albuminuria and kidney function independently predict cardiovascular and renal outcomes in diabetes. J Am Soc Nephrol. 2009;20(8):1813–1821.
- Wen CP, Cheng TY, Tsai MK, et al. All-cause mortality attributable to chronic kidney disease: a prospective cohort study based on 462 293 adults in Taiwan. Lancet. 2008;371(9631):2173–2182.
- Remuzzi G, Benigni A, Remuzzi A. Mechanisms of progression and regression of renal lesions of chronic nephropathies and diabetes. J Clin Invest. 2006;116(2):288–296.
- Lim D, Lee DY, Cho SH, Kim OZ, Cho SW, An SK, Kim HW, Moon KH, Lee MH, Kim B. Diagnostic accuracy of urine dipstick for proteinuria in older outpatients. Kidney Res Clin Pract. 2014 Dec;33(4):199-203.
- Tomonaga Y, Risch L, Szucs TD, Ambühl PM. The prevalence of chronic kidney disease in a primary care setting: a Swiss cross-sectional study. PLoS One. 2013;8(7):e67848.
- White SL, Yu R, Craig JC, Polkinghorne KR, Atkins RC, Chadban SJ. Diagnostic accuracy of urine dipsticks for detection of albuminuria in the general community. Am J Kidney Dis. 2011 Jul;58(1):19-28.
- Verma V, Kant R, Sunnoqrot N, Gambert SR. Proteinuria in the elderly: evaluation and management. Int Urol Nephrol. 2012 Dec;44(6):1745-51.
- Jones CA, Francis ME, Eberhardt MS, Chavers B, Coresh J, Engelgau M, Kusek JW, Byrd-Holt D, Narayan KM, Herman WH, Jones CP, Salive M, Agodoa LY. Microalbuminuria in the US population: third National Health and Nutrition Examination Survey. Am J Kidney Dis. 2002 Mar;39(3):445-59.
- Brenner and Rector's The Kidney, 2-Volume Set, 11th Edition. By Alan S. L. Yu, MD, Glenn M. Chertow, MD, Valerie Luyckx, MBBCh, MSc, Philip A. Marsden, MD, Karl Skorecki, MD, FRCP(C), FASN and Maarten W. Taal, MBChB, MMed, MD, FCP(SA), FRCP. 2019.
- Lamb EJ, MacKenzie F, Stevens PE. How should proteinuria be detected and measured? Ann Clin Biochem. 2009;46(Pt 3):205–217.
- Atkins RC, Briganti EM, Zimmet PZ, et al. Association between albuminuria and proteinuria in the general population: the AusDiab study. Nephrol Dial Transplant. 2003;18(10):2170–2174.
- Kidney Disease: Improving Global Outcomes (KDIGO) CKD Work Group. KDIGO clinical practice guideline for the evaluation and management of chronic kidney disease. Kidney Int Supple. 2013;3(1):1–150.
- Karalliedde J., Viberti G. Microalbuminuria and cardiovascular risk. Am J Hypertens. 2004;17(10):986–993. DOI:10.1016/j.amjhyper.2004.08.010.
- Le W, et al. Nephrol Dial Transplant. 2012;27:1479–1485.
- Masoud S, et al. Clinical Predictors of Long-term Outcomes in C3 Glomerulopathy and Immune-Complex Membranoproliferative Glomerulonephritis within the UK RaDaR Registry. https://doi.org/10.1101/2024.02.03.24301605.
- Evaluation of Urinary Indices for Albuminuria and Proteinuria in Patients with Chronic Kidney Disease. Dennis Sung Chul Hong, Il Hwan Oh, Joon Sung Park et al. 2016 Kidney Blood Press Res.
- Transforming growth factor-beta and the glomerular filtration barrier Ayesha Ghayur, Peter J. Margetts 2013. Kidney Research and Clinical Practice.
11287607/IPT/DIG/10.24/0