В настоящее время достигнут прогресс в понимании патофизиологических механизмов, лежащих в основе многих нефрологических заболеваний, что привело к появлению инновационных терапевтических направлений в нефрологии. Гиперактивация альтернативного пути комплемента играет важную роль в патогенезе подавляющего большинства гломерулярных заболеваний. В целом, в основе патогенеза таких болезней могут лежать как приобретенные факторы (антитела к конвертазам альтернативного пути), так и генетически опосредованные (мутации генов, кодирующих регуляторы альтернативного пути активации комплемента), а в роли триггерных механизмов зачастую выступают аутоиммунные заболевания, инфекции, моноклональные гаммапатии. Ниже представлена информация о системе комплемента, ее роли в патогенезе нефрологических заболеваний и перспективах коррекции ее нарушений.
Пожалуйста, нажмите на интересующий вас раздел, чтобы его открыть.
Значение системы комплемента в патогенезе нефрологических заболеваний
Система комплемента представляет собой каскад ферментов, играющих важную роль в борьбе с инфекционными заболеваниями и являющихся неотъемлемой частью врожденного иммунитета1. Система включает в себя более 50 белков, находящихся в плазме крови, а также на поверхности клеток. Функция системы комплемента заключается в распознавании чужеродных агентов и поврежденных/измененных собственных клеток, а также разделении их по принципу «свой-чужой»2, 3.
Необходимый минимум:
Повышение антителозависимого иммунного ответа и формирование иммунологической памяти.
Лизис чужеродных клеток.
Удаление иммунных комплексов.
Компоненты системы комплемента выполняют разнообразные биологические функции, такие как стимуляция хемотаксиса и инициирование дегрануляции тучных клеток независимо от IgE2, 3.
Помимо своей функции во врожденном иммунитете, система комплемента играет ключевую роль в иммунном контроле, регуляции приобретенного иммунитета и гомеостаза4, 5.
Исследование роли системы комплемента в патогенезе нефрологических заболеваний стало важным для пациентов с верифицированным диагнозом аГУС, С3-гломерулопатией или IgA-нефропатией. Зачастую имеющаяся в арсенале нефролога терапия не достаточна для эффективного контроля данных заболеваний, что увеличивает интерес практикующих специалистов к новым терапевтическим подходам. Тяжелые побочные эффекты длительной терапии высокими дозами глюкокортикоидов, такие как увеличение массы тела, перераспределение жировой ткани, гипергликемия, отеки, неконтролируемая артериальная гипертензия, остеопороз, а также гормональные и психические изменения, значительно снижают качество жизни пациентов и не всегда позволяют достичь ремиссии заболевания6.
Стратегией выбора терапии является применение терапии, способной остановить прогрессирование заболевания и продлить срок до диализ-потребной ХБП. Эффективность терапии в нефрологии прежде всего заключается в:
- снижении протеинурии;
- замедлении ухудшения функции почек;
- улучшении общего самочувствия, повседневной активности и (или) выживаемости6.
Молекулярные механизмы комплемент-блокирующей терапии
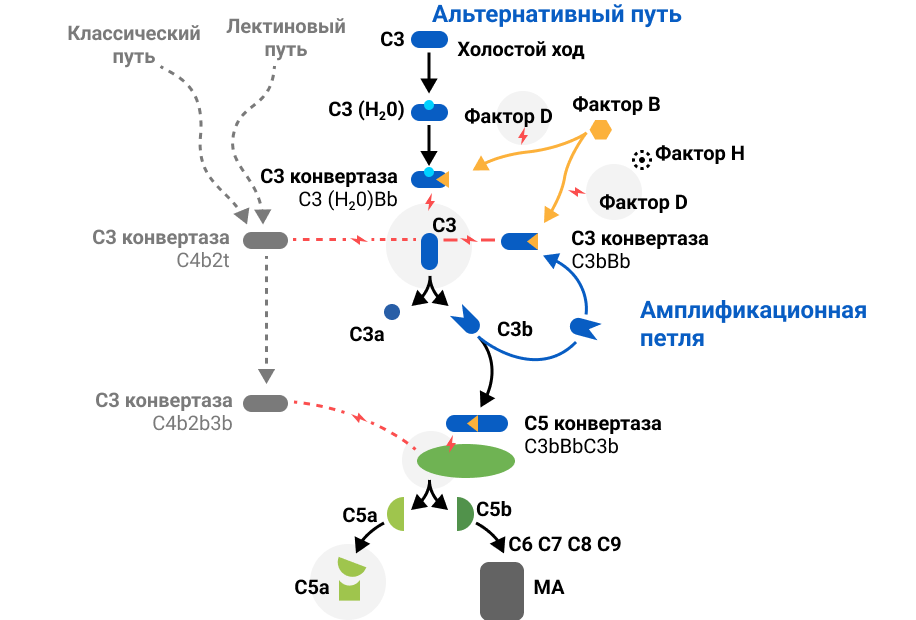
Система комплемента — это взаимосвязанный поток химических реакций, являющихся ключевой частью врожденного иммунитета. Всего существует три пути активации комплемента: классический, лектиновый и альтернативный. Каждый из этих путей направлен на активацию C3 и C5 белков комплемента и завершается общим терминальным путем, который приводит к лизису патогенных клеток. Активация системы комплемента инициирует строго контролируемый каскад протеолитических расщеплений4, 5.
- Классический путь активации возникает при образовании комплексов антиген-антитело, он инициируется иммунными комплексами, которые взаимодействуют с C1q, что приводит к образованию конвертазы C3—C4b—C2a классического пути4, 5.
- Лектиновый путь генерирует ту же самую конвертазу C3—C4b—C2a, но он активируется в результате связывания маннозосвязывающего лектина (или фиколина) с углеводными фрагментами на поверхности патогена4, 5.
- Альтернативный путь характеризуется постоянной низкоинтенсивной активностью и функционирует непрерывно. Встреча с компонентами микробной клеточной стенки, аутоантителами и другими биологически активными субстанциями запускает петлю амплификации, что многократно увеличивает активность альтернативного пути комплемента и приводит к запуску следующих этапов, завершающихся образованием мембраноатакующего комплекса4, 5. В процессе образования С3-конвертазы как в фоновом режиме, так и посредством амплификационной петли важную роль играет фактор В.
Приложение 1.
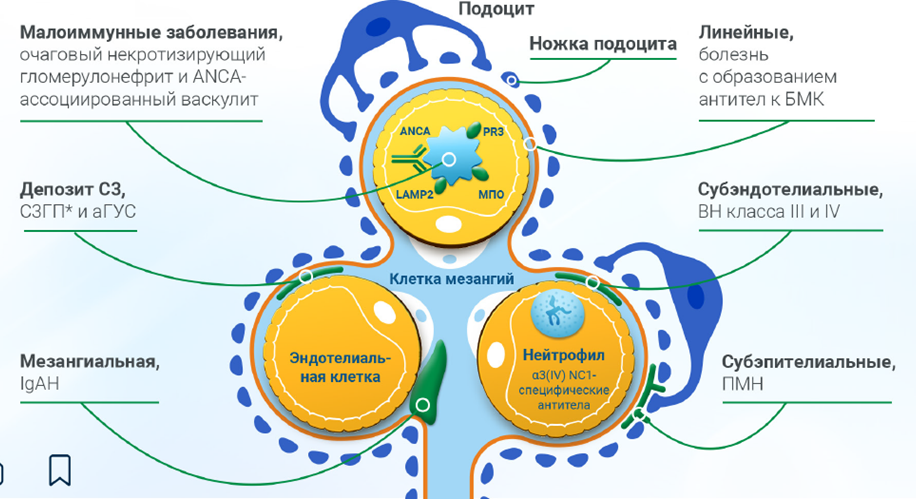
Нарушение регуляции системы комплемента оказывает влияние на почки и может способствовать развитию заболеваний, связанных с повреждением почечных структур. Предрасположенность к возникновению данных заболеваний может быть обусловлена постоянной доступностью бесклеточных субэндотелиальных тканей для взаимодействия с активаторами комплемента и недостаточной экспрессией ингибиторов системы комплемента. Уязвимость почек также связана с их огромной пропускной фильтрационной нагрузкой. Нарушение регуляции системы комплемента может вызвать тяжелые поражения почек, клинически проявляющиеся в развитием нефротического синдрома, в частности при мембранозной нефропатии, С3-гломерулопатии и нефритическом синдроме, например, при IgA-нефропатии7—9.
Приложение 2. Локализация отложений комплемента определяет характер почечной патологии9.
С клинической точки зрения наиболее важным является альтернативный путь активации комплемента. Например, именно нарушение регуляции альтернативного пути занимает центральное место в патогенезе С3-гломерулопатии. У более чем 90% пациентов с C3-гломерулопатией нарушение регуляции альтернативного пути происходит в жидкой фазе и в гликокаликсе, который перекрывает клубочковые эндотелиальные поры. При этом дисбаланс в регуляции альтернативного пути может привести к устойчивой активации C3 и отложению C3b в гликокаликсе и базальной мембране. Депозиты C3b в гликокаликсе могут стать основой для формирования C3-конвертазы и, в конечном итоге, образования C5-конвертазы и активации мемраноатакующего комплекса. Активация комплемента приводит к образованию двух мощных анафилатоксинов — C3a и C5a1, — что способствует привлечению иммунокомпетентных клеток в очаг воспаления и усугублению морфологических изменений. Моноклональные гаммапатии также играют роль в патогенезе С3-гломерулопатии — моноклональные белки могут выступать в качестве нефритических факторов, стабилизирующих C3-конвертазы, или действовать как аутоантитела, направленные против компонентов комплемента3, 10.
Новые комплемент-блокирующие лекарственные препараты
Комплемент-блокирующая терапия направлена на подавление активности системы комплемента и способствует тем самым прекращению процессов лизиса клеток макроорганизма, а также снижению микроциркуляторного тромбообразования. В настоящее время проводятся исследования ряда препаратов для лечения гломерулярных заболеваний, включая IgA-нефропатию, С3-гломерулопатию, мембранозную нефропатию, болезнь минимальных изменений и другие. К началу 2024 года известно о более чем 10 комплемент-блокирующих молекулах, находящихся в той или иной фазе изучения. С учетом важной роли гиперактивации системы комплемента и увеличения количества препаратов, воздействующих на различные ее компоненты, в последние пять лет было проведено значительное количество исследований в области таргетной терапии, направленной на снижение активности комплемента13.
Технологические достижения и клинический опыт создают уверенность в новых терапевтических стратегиях, направленных на снижение активности системы комплемента. Расширяющийся список клинических исследований и увеличивающееся количество ингибиторов комплемента, которые разрабатываются и изучаются на доклинических стадиях, демонстрируют их перспективность в терапии гломерулярных заболеваний. Учитывая гетерогенность патогенеза нефрологических заболеваний, остается нерешенным вопрос оптимальной точки приложения комплемент-блокирующих препаратов как для различных морфологических форм гломерулонефритов, так и внутри каждой гломерулопатии при различных клинических проявлениях заболевания. Тщательная стратификация пациентов станет ключевым аспектом на пути к успешному внедрению новых терапевтических подходов в реальную практику врача-нефролога. Также остается открытым вопрос о сравнительном профиле безопасности данных препаратов. И, наконец, еще одной проблемой является понимание длительности комплемент-блокирующей терапии после достижения клинической ремиссии заболевания. Появление таргетных, селективных терапевтических средств, направленных на снижение активности системы комплемента, открывает возможности для новых стратегий лечения заболеваний почек. В этой связи крайне необходима разработка новых эффективных и безопасных вариантов лечения14.
Список сокращений
- IgE — иммуноглобулин Е;
- аГУС — атипичный гемолитико-уремический синдром;
- IgA — иммуноглобулин А;
- C3ГП — C3-гломерулопатия;
- БМК — базальная мембрана клубочков;
- ANCA — антитела к цитоплазме нейтрофилов;
- LAMP2 — лизосомальный мембранный белок-2;
- PR3 — протеиназа-3;
- MПO — миелопероксидаза.
Источники
- Dunkelburger JR, Song W-C, Cell Res. 2010;20:34–50.
- Ghebrehiwet B, F1000 Res. 2016;5:2840.
- Smith RJH, et al, Nat Rev Nephrol. 2019;15:129–43.
- Merle NS, et a,. Front Immunol. 2015;6:262.
- Ort M, et al, Front Immunol. 2020;11:599417.
- Feldman D.L., White E.M., Julian B. et al. The Voice of the Patient. Externally Led Patient–Focused Drug Development Meeting on IgA Nephropathy. National Kidney Foundation. 2020; 87.
- De Vriese AS, et al. J Am Soc Nephrol 2015;26:2917–29.
- Khanna R. Mo Med. 2011;108:33–6.
- Kurts C, et al. Nat Rev Immunol 2013;13:738–53.
- Caravaca-Fontán F, et al. Nephron 2020;144(6):272–80.
- Клинические рекомендации «Атипичный гемолитико-уремический синдром». Рубрикатор клинических рекомендаций. [Электронный ресурс]. URL: https://cr.minzdrav.gov.ru/schema/550_2 Дата последнего обращения: февраль 2024 г.
- Rittirsch D, Flierl MA, Ward PA. Harmful molecular mechaniСМС in sepsis. Nat Rev Immunol. 2008 Oct;8(10):776–87.
- Захарова Е.В., Зыкова А.С. С3 гломерулопатия: путь от световой микроскопии до таргетной терапии. Нефрология и диализ. 2023. 25(3):345–359.
- Maurizio Salvadori. Recent Advances in Targeting Complement in Glomerular Disease. EMJ Nephrol. 2023;11[1]:90–100.
11376906/IPT/DIG/03.25/1