На Конгрессе Американской академии неврологии (AAN) 2024 г. были представлены результаты исследования ALITHIOS за 6 лет.
Для российской аудитории результаты этой продленной фазы исследования по офатумумабу1 были впервые озву-чены на конгрессе МАВРС в 2024 г.
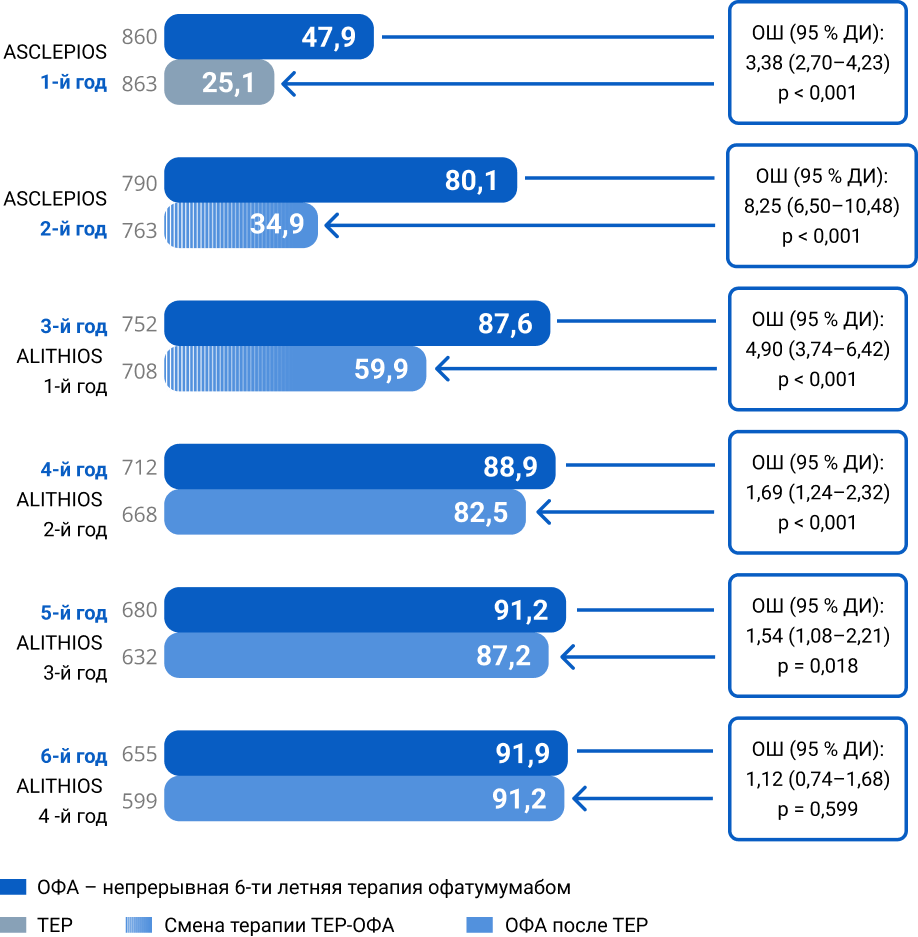
Пациенты, достигшие NEDA (%)2
- На терапии офатумумабом наблюдалось быстрое достижение NEDA-3, которое сохранялось в течение 6 лет
- На терапии терифлуномидом показатели NEDA-3 были значимо ниже, но после перехода на офатумумаб наблюдался быстрый рост доли пациентов, достигших NEDA-3
- На 6-м году показатель NEDA-3 был достигнут у 9 из 10 пациентов в обеих группах с офатумумабом
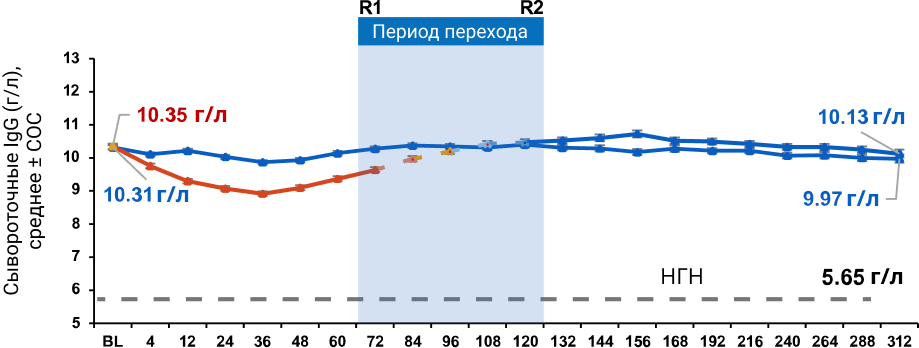
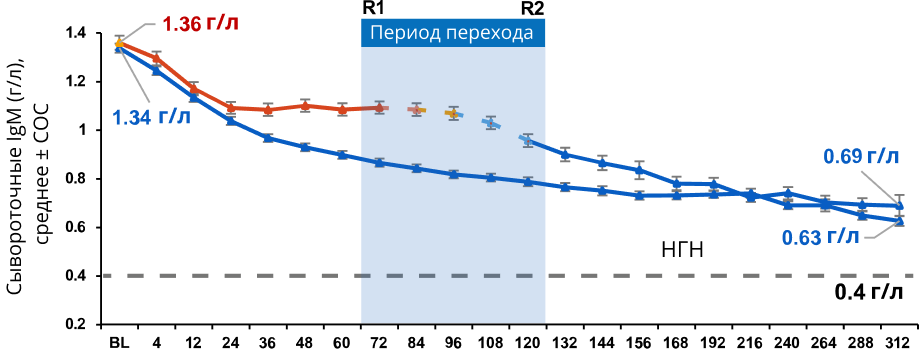
Уровни сывороточных иммуноглобулинов2
- Средний уровень IgG оставался стабильным в течение 6 лет лечения
- Средний уровень IgM снизился, но остался выше нижней границы нормы (НГН)
- Не наблюдалось клинически значимой связи между уровнями IgG/IgM <НГН и риском серьезных инфекций
Средний уровень иммуноглобулина G (IgG)
Средний уровень иммуноглобулина М (IgM)
Профиль безопасности2
- Частота НЯ и СНЯ с поправкой на экспозицию на 100 пациенто-лет (EAIR) в течение 6 лет лечения офатумумабом оставалась стабильной
- Никаких новых сигналов безопасности выявлено не было
- Частота серьезных инфекций с течением времени не увеличивалась на фоне лечения офатумумабом в течение 6 лет (EAIR: 1,48 [95% ДИ: 1,23–1,77])
- Заболеваемость злокачественными новообразованиями на фоне терапии офатумумабом за 6 лет не увеличивалась с течением времени
NEDA-3 — нет данных, свидетельствующих об активности заболевания, а именно: нет подтверждённого усиления инвалидизации за 6 месяцев, нет подтверждённых обострений рассеянного склероза, нет новых T2-очагов или увеличения в размерах старых T2-очагов, нет новых T1-очагов, контрастируемых гадолинием; ОФА — офатумумаб; ТЕР — терифлуномид; ОФА-ОФА — непрерывный приём офатумумаба; Смена терапии ТЕР-ОФА — процесс перехода участников исследования с терифлуномида на офатумумаб; ввиду того, что по своему дизайну исследования ASCLEPIOS I и ASCLEPIOS II были исследованиями, управляемыми исходами, пациенты совершали переход в разные моменты времени с начала приёма терифлуномида; таким образом, переход пациентов с терифлуномида на офатумумаб начался во 2-м году и закончился в 3-м году; ОФА после ТЕР — пациенты, которые на данный момент принимают офатумумаб, но ранее в рамках наблюдения принимали терифлуномид; ОШ — отношение шансов; ДИ — доверительный интервал; N — общее число пациентов в каждой группе, за исключением тех, кто досрочно прекратил лечение по причинам, отличным от недостаточной эффективности или смертельного исхода, и достигших NEDA до досрочного прекращения лечения. На временном участке «Период перехода» указаны данные участников исследования, которые в исследованиях ASCLEPIOS I и ASCLEPIOS II изначально принимали терифлуномид; при визуализации результатов на временном участке «Период перехода» данные пациентов, с начала исследований ASCLEPIOS I и ASCLEPIOS II принимавших офатумумаб, не использовались. Для группы, изначально принимавшей терифлуномид с последующим переходом на офатумумаб, использовались данные с момента приёма первой дозы терифлуномида до момента приёма последней дозы офатумумаба плюс 100 дней или иной период до даты окончания сбора данных. R1 — первое после смены препарата обследование первого пациента, совершившего переход с терифлуномида на офатумумаб (72 недели); R2 — последнее перед сменой препарата обследование последнего пациента, еще не совершившего переход с терифлуномида на офатумумаб (120 недель). Во всех процедурах сводного анализа использовались фиксированные значения нижней границы нормы (НГН) (согласно референсным значениям в исследовании ALITHIOS): IgG — 5,65 г/л; IgM — 0,4 г/л. НГН — нижняя граница нормы; СОС — стандартная ошибка среднего; BL — исходные показатели; Ig — иммуноглобулины; IgG — иммуноглобулины класса G; IgM — иммуноглобулины класса M. НЯ — нежелательное явление; СНЯ — серьёзное нежелательное явление; ИМП — инфекция мочевыводящих путей; EAIR — частота событий на 100 пациенто-лет.
Список литературы
- Инструкция по применению лекарственного препарата (ОХЛП) Бонспри® ЛП-№(001332)-(РГ-RU)-251022 (https://grls.rosminzdrav.ru/Grls_View_v2.aspx?routingGuid=7979032d-b214-..., ссылка активна на 06.09.2024
- Heinz Wiendl, et al. Poster presented at AAN 2024; P9.010 https://www.medcommshydhosting.com/MSKnowledgecenter/aan.html#tabs-1-1
Сайт предназначен для сотрудников здравоохранения.
Информация предназначена для граждан Российской Федерации. Не является медицинским заключением или постановкой диагноза.
Обратитесь к лечащему врачу.
11266483/OFA/DIG/09.24/0