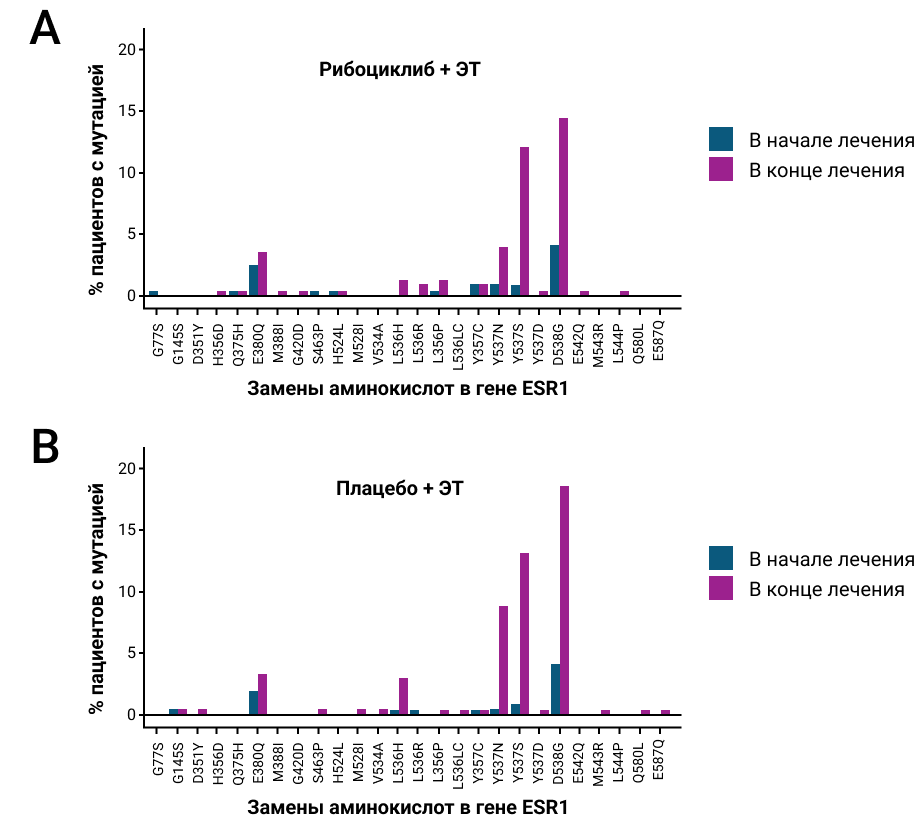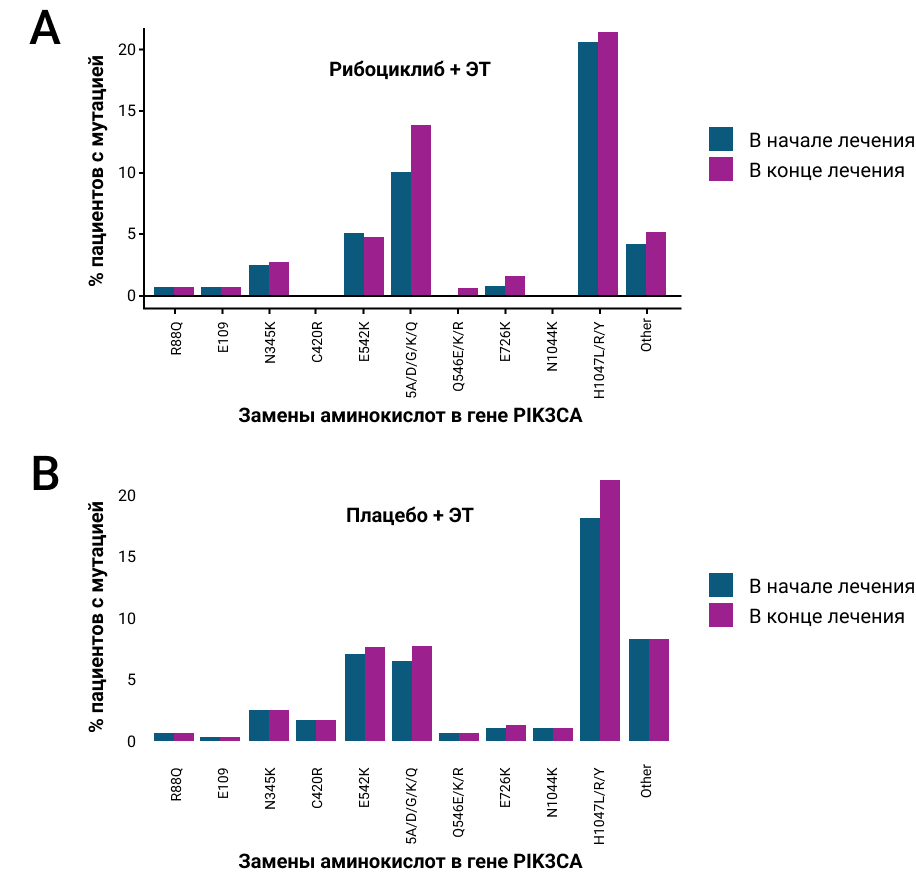Резюме
- Проведен анализ встречаемости мутаций, ассоциированных с возникновением эндокринной резистентности, у пациентов с HR+ HER2− рРМЖ перед началом и после окончания лечения в исследованиях MONALEESA-2, -3 и -7.
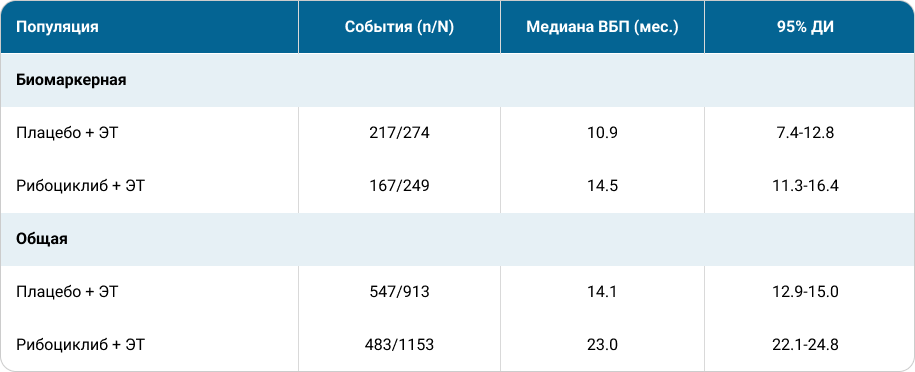
- Биомаркерная популяция (N=523) состояла преимущественно из пациентов с более ранним прогрессированием и неблагоприятным прогнозом по сравнению с общей популяцией. Назначение рибоциклиба пациентам из биомаркерной популяции приводило к улучшению медианы ВБП по сравнению с пациентами этой же популяции, принимавшими плацебо + ЭТ.
- В конце лечения встречаемость мутаций увеличилась в генах RB1, SPEN, TPR, PCDH15 и FGFR2 в группе рибоциклиба; PBRM1 в группе плацебо; и ESR1 в обеих группах терапии.
- Повышение встречаемости мутаций в генах RB1 и SPEN в конце лечения были специфичны для группы рибоциклиба + ЭТ.
- Среди мутаций гена ESR1 наиболее распространенными в обеих группах были D538G, Y537S/N/C/D, E380Q и L536H/P/R/LC.
- Для гена PIK3CA не было выявлено увеличения количества мутаций в «горячих точках» в обеих группах.
- Увеличение частоты мутаций, которые могут быть связаны с развитием резистентности к последующей терапии ингибиторами CDK4/6 при оставлении этой опции на вторую линию терапии, происходило не только у пациентов, принимавших рибоциклиб + ЭТ, но и у пациентов, принимавших моноЭТ, что может служить дополнительным поводом в пользу назначения рибоциклиба в первой линии.
Введение
Современным стандартом лечения пациентов с гормонозависимым HER2-негативным распространенным раком молочной железы (HR+ HER2− рРМЖ) является комбинация ингибитора CDK4/6 и эндокринной терапии (ЭТ)1,2. Клинические исследования III фазы MONALEESA-2, -3 и -7 продемонстрировали статистически и клинически значимое преимущество терапии рибоциклибом + ЭТ по сравнению с моноЭТ в выживаемости без прогрессирования (ВБП) и общей выживаемости (ОВ) у пациентов с HR+ HER2− рРМЖ как в первой, так и во второй линии терапии3–8. Преградой для лечения может стать внутренняя или приобретенная лекарственная устойчивость9. Но на сегодняшний день клинических данных относительно биомаркеров и механизмов резистентности к ингибиторам CDK4/6 недостаточно.
Анализ циркулирующей опухолевой ДНК (цоДНК) пациентов, включенных в исследования MONALEESA-2, -3 и -7, перед началом лечения выявил маркеры, предсказывающие чувствительность или внутреннюю резистентность к комбинации рибоциклиб + ЭТ10. Гены ERBB2, FAT3, FRS2, MDM2, SFRP1 и ZNF217 были идентифицированы как потенциальные прогностические биомаркеры чувствительности к рибоциклибу, в то время как гены ANO1, CDKN2A/2B/2C и RB1 были связаны со снижением чувствительности к рибоциклибу. Задачей нового исследования11 стал анализ мутаций, связанных с приобретением эндокринной резистентности, у пациентов с HR+ HER2− рРМЖ в объединенных исследованиях MONALEESA. Для этого были проанализированы парные образцы цоДНК (перед началом и после окончания лечения).
Результаты
В биомаркерную популяцию, для которой были получены парные образцы цоДНК, было включено 523 пациента. Медиана наблюдения (время от рандомизации до прекращения лечения из-за прогрессирования) в биомаркерной популяции составила 12,9 месяцев, а медиана ВБП — 14,5 месяцев (95% ДИ: 11,3–16,4) в группе рибоциклиба и 10,9 месяцев (95% ДИ: 7,4–12,8) в группе плацебо. Биомаркерная популяция состояла в большей степени из пациентов с более ранним прогрессированием и худшим ответом/прогнозом по сравнению с общей популяцией (таб. 1).
Таблица 1. ВБП в биомаркерной и общей популяции пациентов в объединенном анализе исследований MONALEESA11.
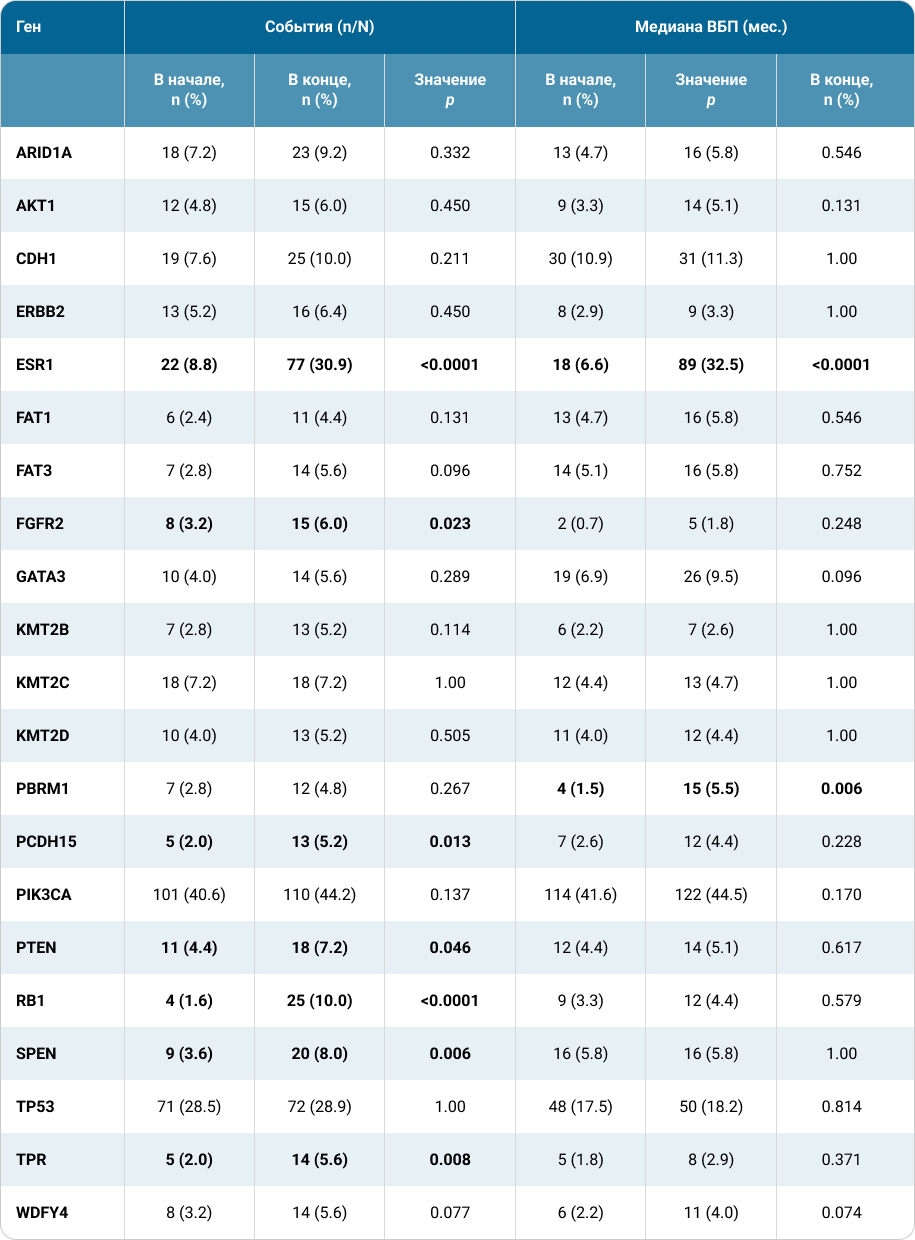
Анализ соматических изменений показал, что в конце лечения 21 ген имел распространенность изменений > 5%. Наблюдалась тенденция к более высокой фракции цоДНК в конце лечения по сравнению с исходным уровнем (P=0,08).
Частота мутаций в конце исследования по сравнению с исходным уровнем в группе рибоциклиба была значимо выше в генах RB1 (на 8,4%, р < 0.0001), SPEN (на 4,4%, р = 0.006), TPR (на 3,6%, р = 0.008), PCDH15 (на 3,2%, р = 0.013) и FGFR2 (на 2,8%, р = 0.023). Частота мутаций в гене ESR1 в конце лечения значимо увеличилась по сравнению с исходным уровнем как в группе рибоциклиба + ЭТ (на 22,1%, р < 0.0001), так и в группе плацебо + ЭТ (на 25,9%, р < 0.0001). Распространенность мутаций гена PBRM1 значимо увеличилась только в группе плацебо + ЭТ (на 4,0%, р = 0.006) (таб. 2).
Вероятность появления мутаций в генах RB1 и SPEN в конце лечения была выше в группе рибоциклиба + ЭТ (ОР 16.28 [95% ДИ:4,37–83,75] и ОР 14.73 [95% ДИ: 2.76–121.24] соответственно), чем в группе плацебо + ЭТ (ОР 1.80 [95% ДИ: 0.61–5.62] и ОР 1.27 [95% ДИ: 0.30–5.11] соответственно) (рис. 1).
Вероятность появления мутаций в генах TPR, PCDH15 и FGFR2 в конце лечения также была выше в группе рибоциклиба + ЭТ (ОР 21.29 [95% ДИ: 2.91–319.00], ОР 8.82 [95% ДИ: 1.72–66.44] и ОР 15,97 [95% ДИ: 2.12–344.21] соответственно). Однако различия между группами статистически не значимы, поэтому этот эффект нельзя считать специфичным для рибоциклиба (рис. 1).
Вероятность появления мутаций в гене PBRM1 в конце лечения была выше в группе плацебо + ЭТ (ОР 7.21 [95% ДИ: 2.02–32.84]), чем в группе рибоциклиба + ЭТ (ОР 2.68 [95% ДИ: 0.82–9.76]). Этот эффект статистически также нельзя считать специфичным для моноЭТ (рис. 1). Увеличение вероятности появления мутаций в гене ESR1 в конце лечения наблюдалось в обеих группах терапии, с более высоким ОР в группе плацебо + ЭТ по сравнению с группой рибоциклиба + ЭТ (ОР 14.74 [95% ДИ: 7.14–31.55] и ОР 7.27 [95% ДИ: 3.75–15.20] соответственно. Статистически достоверной разницы между вариантами терапии также не выявлено (рис. 1).
Таблица 2. Распространенность мутаций в биомаркерной популяции пациентов в начале и конце лечения в объединенном анализе исследований MONALEESA11 (статистически значимые изменения выделены жирным шрифтом).
Наиболее распространенными приобретенными мутациями гена ESR1, наблюдаемыми в конце лечения в обеих группах терапии, были (рибоциклиб + ЭТ vs. плацебо + ЭТ): D538G (14,5% vs. 18,6%), Y537S (12,0% vs. 13,1%), Y537N (4,0% vs. 8,8%) и E380Q (3,6% vs. 3,3%). Мутации Y537N/C/D и L536H/P/R/LC также были обнаружены с более высокой распространенностью в конце лечения по сравнению с исходным уровнем в обеих группах терапии (рис. 2).
Распространенность мутаций в горячих точках гена PIK3CA в начале и в конце лечения была схожей в обеих группах терапии (рис. 3).
Рисунок 1. Вероятность появления мутаций в конце лечения в зависимости от терапии в биомаркерной популяции пациентов в объединенном анализе исследований MONALEESA11.
Рисунок 2. Наиболее распространенные аминокислотные замены в гене ESR1 в начале и в конце лечения в объединенном анализе исследований MONALEESA11.
Рисунок 3. Наиболее распространенные аминокислотные замены в гене PIK3CA в начале и в конце лечения в объединенном анализе исследований MONALEESA11.
Заключение
Анализ парных образцов цоДНК, полученных перед началом и после окончания лечения пациентов с HR+/HER2− рРМЖ в исследованих MONALEESA-2, -3, -7 выявил приобретенные изменения генов у пациентов, принимавших рибоциклиб + ЭТ или плацебо + ЭТ11. Полученные результаты могут улучшить понимание механизмов возникновения приобретенной резистентности к ингибиторам CDK4/6 и в будущем могут быть полезны для разработки системного лечения после прогрессирования на ингибиторах CDK4/6. Важно отметить, что назначение рибоциклиба пациентам из биомаркерной популяции приводило к положительному клиническому эффекту — улучшению медианы ВБП по сравнению с пациентами этой же популяции, принимавшими моноЭТ (таб. 1). Увеличение частоты мутаций, которые могут быть связаны с развитием резистентности к последующей терапии ингибиторами CDK4/6 при оставлении этой опции на вторую линию, происходило не только у пациентов, принимавших рибоциклиб + ЭТ, но и у пациентов, принимавших моноЭТ. Это наблюдение может служить дополнительной аргументацией в пользу назначения рибоциклиба в первой линии. К тому же полученные данные согласуются с результатами исследования MONALEESA-3, показавшими, что назначение рибоциклиба в первой линии терапии имело большую эффективность, чем во второй12.
Список сокращений
- ВБП — выживаемость без прогрессирования;
- ДИ — доверительный интервал;
- ЭТ — эндокринная терпия;
- ОР — отношение рисков;
RIB — рибоциклиб;
PBO — плацебо.
Список литературы
- Cardoso F, et al. 5th ESO-ESMO international consensus guidelines for advanced breast cancer (ABC 5). Ann Oncol. 2020;31(12):1623-1649.
- Gradishar WJ, et al. NCCN Guidelines® Insights: Breast Cancer, Version 4.2023. JNCCN. 2023;21(6):594-608.
- Hortobagyi GN, et al. Ribociclib as First-Line Therapy for HR-Positive, Advanced Breast Cancer. N Engl J Med. 2016;375(18):1738-1748.
- Hortobagyi GN, et al. Overall Survival with Ribociclib plus Letrozole in Advanced Breast Cancer. N Engl J Med. 2022;386(10):942-950.
- Slamon DJ, et al. Phase III Randomized Study of Ribociclib and Fulvestrant in Hormone Receptor-Positive, Human Epidermal Growth Factor Receptor 2-Negative Advanced Breast Cancer: MONALEESA-3. J Clin Oncol. 2018;36(24):2465-2472.
- Slamon DJ, et al. Overall Survival with Ribociclib plus Fulvestrant in Advanced Breast Cancer. N Engl J Med. 2020;382(6):514-524.
- Tripathy D, et al. Ribociclib With a Nonsteroidal Aromatase Inhibitor and Goserelin in Premenopausal Women With HR-positive, HER2-negative ABC: MONALEESA-7 Age Subgroup Analysis. Poster presented at: SABCS; 2018.
- Im SA, et al. Overall Survival with Ribociclib plus Endocrine Therapy in Breast Cancer. N Engl J Med. 2019;381(4):307-316. doi:10.1056/NEJMoa1903765
- Huang J, et al. CDK4/6 inhibitor resistance mechanisms and treatment strategies (Review). Int J Mol Med. 2022;50(4).
- André F, et al. Pooled ctDNA analysis of MONALEESA phase III advanced breast cancer trials. Ann Oncol. 2023;34(11):1003-1014.
- André F, et al. Acquired gene alterations in patients treated with ribociclib plus endocrine therapy or endocrine therapy alone using baseline and end-of-treatment circulating tumor DNA samples in the MONALEESA-2, -3, and -7 trials. Ann Oncol. 2024 Sep 21:S0923-7534(24)04018-3. doi: 10.1016/j.annonc.2024.09.010.
- Neven P, et al. Updated overall survival from the MONALEESA-3 trial in postmenopausal women with HR+/HER2- advanced breast cancer receiving first-line ribociclib plus fulvestrant. Breast Cancer Res. 2023;25(1):103. doi: 10.1186/s13058-023-01701-9.
11298211/RIB/web/11.24/0