Исследование NATALEE* продемонстрировало статистически и клинически значимое улучшение выживаемости без признаков инвазивного заболевания (ВБИЗ) у пациентов с HR+ HER2− РМЖ при добавлении рибоциклиба к нестероидным ингибиторам ароматазы (ИА) по сравнению с терапией только ИА: ОР 0,715, 95% ДИ 0,609–0,840, p < 0,00011,2 (4—летние данные).
Основываясь на результатах NATALEE* Управление по контролю за продуктами и лекарствами США (FDA) и Европейская комиссия одобрили комбинацию рибоциклиба + НСИА для адъювантной терапии пациентов с HR+ HER2− РМЖ II/III стадии с высоким риском рецидива3,4. Обновленное руководство Российского общества онкомаммологов (РООМ) «Золотой стандарт профилактики, диагностики, лечения и реабилитации больных РМЖ 2025» также включает рекомендацию по усилению адъювантной гормонотерапии добавлением рибоциклиба для пациентов высокого клинического риска рецидива (N+ статус; N0 в сочетании с T3–4; N0 в сочетании с T2 и G3; T2–4N0 или N+ у пациентов ≤ 40 лет)5.
Первоначальная доза рибоциклиба в NATALEE составляла 400 мг/день, однако дозировка могла быть снижена до 200 мг/сутки для коррекции нежелательных явлений (НЯ)1. Анализ 3—летней ВБИЗ при медиане наблюдения 33,3 мес. показал, что снижение дозы рибоциклиба из-за НЯ не повлияло на эффективность лечения вне зависимости от времени, прошедшем от начала лечения до коррекции дозы6. Эти результаты были дополнительно подтверждены на ежегодном конгрессе SABCS в 2024 году7.
Результаты
Исходные характеристики пациентов
Сбор данных для анализа, представленного на SABCS 2024, был окончен 29 апреля 2024 г. Медианное время наблюдения для ВБИЗ составило 44,2 мес.
Из 2526 пациентов, получавших лечение рибоциклибом + ИА, снижение дозы рибоциклиба потребовалось 687 (27,2%) пациентам. Исходные характеристики пациентов были сбалансированы между подгруппами (табл. 1).
Таблица 1. Исходные характеристики пациентов в подгруппах с редукцией и без редукции дозы рибоциклиба
a — Отсутствует данные у 1 (0,1%) пациента с редукцией дозы;
б — Отсутствует статус лимфоузлов у 14 (2,0%) пациентов с редукцией дозы и 34 (1,8%) пациента без редукции дозы;
в — Отсутствует данные по ECOG у 1 (0,1%) пациента с редукцией дозы и у 1 (0,1%) пациента без редукции дозы.
Медианная продолжительность приема рибоциклиба была одинаковой в подгруппах с редукцией и без редукции дозы и составила 35,7 мес.
Медианное время до первого снижения дозы в подгруппе с редукцией дозы (n=687) составило 3,3 мес., а основной причиной были НЯ (84,7%, n=582).
Наиболее распространенными НЯ, приведшими к уменьшению дозы среди всех пациентов, принимавших рибоциклиб + ИА (n=2526), были нейтропения (14,1%, n=355), повышение АЛТ (1,9%, n=48), лейкопения (1,7%, n=44) и усталость (1,1%, n=27) (табл. 2).
Среди тех, кто прекратил прием рибоциклиба из-за НЯ (n=509), 70,3% (n=358) не предварительно не снижали дозу.
Таблица 2. НЯ, чаще всего приводившие к снижению дозы рибоциклиба
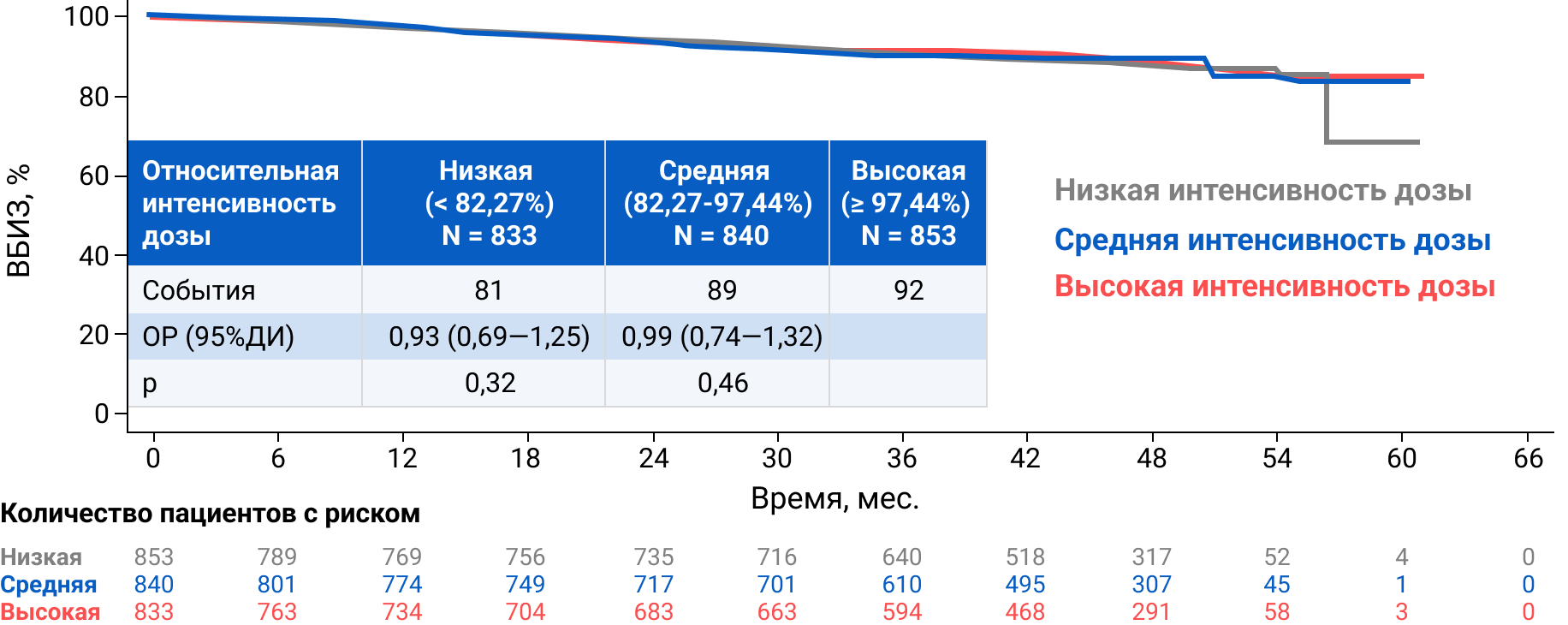
Подгрупповой анализ ВБИЗ в зависимости от относительной интенсивности дозы рибоциклиба
Относительная интенсивность дозы (RDI) – это фактическая кумулятивная доза за все время терапии, деленная на запланированную кумулятивную интенсивность дозы (400 мг/день).
В зависимости от величины относительной интенсивности дозы (RDI) все пациенты были разделены на три когорты: низкая RDI (от 0 до < 82,27%), средняя RDI (от 82,27% до < 97,44%) и высокая RDI (≥ 97,44%).
ВБИЗ была сходной во всех трех когортах пациентов независимо от RDI рибоциклиба (рис. 1): ОР 0,931 (низкая RDI vs высокая RDI) и ОР 0,985 (средняя RDI vs высокая RDI).
Рисунок 1. ВБИЗ в когортах с низкой, средней и высокой относительной интенсивностью дозы (RDI)
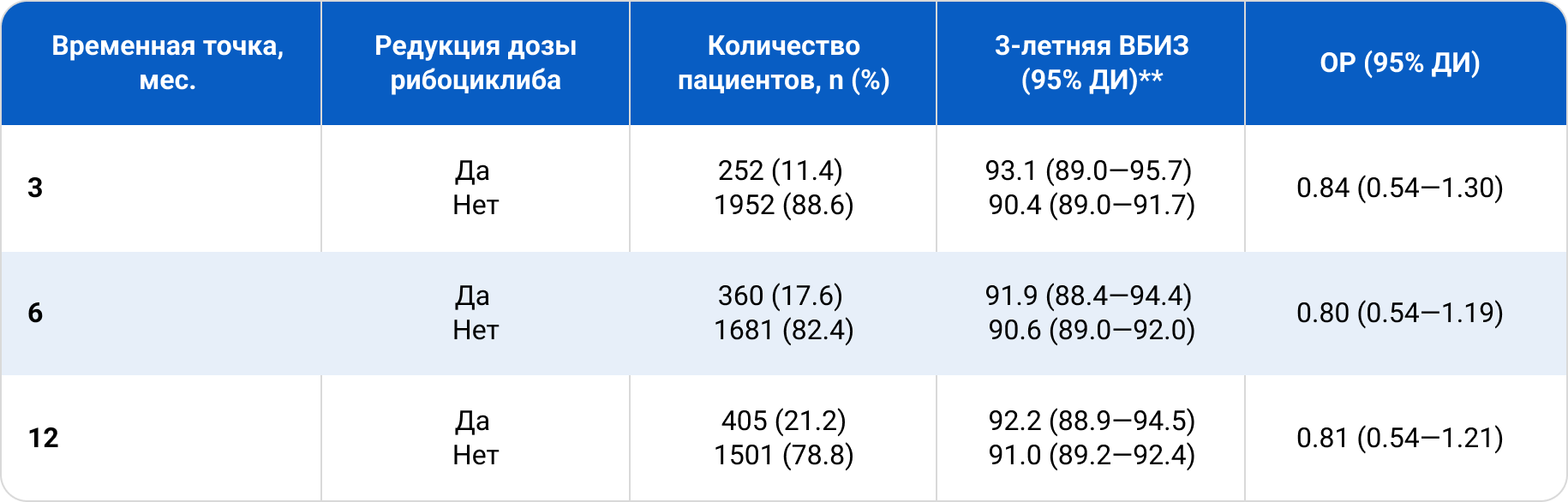
Анализ «пограничных точек»
Для того, чтобы определить влияет ли время, прошедшее от начала лечения до редукции дозы рибоциклиба, на показатели ВБИЗ, был проведен анализ эффективности в нескольких временных точках: 3, 6 и 12 мес. В каждой точке из анализируемой популяции пациентов исключали тех, кто прекращал прием рибоциклиба, оставляя только тех, кто продолжал комбинированную терапию. Таких пациентов делили на две подгруппы — с редукцией дозы и без редукции дозы. В каждой подгруппе анализировали 3—летнюю ВБИЗ, рассчитывая этот показатель не от начала лечения, а от соответствующей пограничной точки. Анализ всех временных точек показал отсутствие отличий ВБИЗ в подгруппах с редукцией дозы и без редукции (табл. 3).
Таблица 3. Анализ ВБИЗ в подгруппах с редукцией дозы в различных временных точках
Важно отметить, что большинство пациентов в исследовании NATALEE, прекративших прием рибоциклиба из-за НЯ (358/509; 70,3%), предварительно не снизили дозу для коррекции НЯ. Возможно, редукция дозы помогла бы продолжить терапию.
Заключение
Таким образом, исследование продемонстрировало возможность безопасного снижения дозы рибоциклиба до 200 мг/день без ущерба для эффективности адъювантной терапии пациентов с HR+ HER2− РМЖ, что позволяет управлять НЯ и поддерживать лечение более длительное время.
Список сокращений
HR+ HER2− РМЖ — положительный по гормональным рецепторам и отрицательный по человеческому рецептору эпидермального фактора роста 2 типа рак молочной железы; NX — регионарные лимфатические узлы не оценивались; АЛТ — аланинаминотрансфераза; RDI — относительная интенсивность дозы; АСТ — аспартатаминотрансфераза; ВБИЗ — выживаемость без признаков инвазивного заболевания; ДИ — доверительный интервал; НСИА — нестероидный ингибитор ароматазы; НЯ — нежелательные явления; ОР — отношение рисков.
*NATALEE — открытое сравнительное исследование III фазы (n=5101), проводимое с целью оценки эффективности и переносимости комбинации рибоциклиба (400 мг в сутки, 21 день прием, 7 дней перерыв; продолжительность приема 3 года) и НСИА (летрозол или анастрозол; продолжительность приема не менее 5 лет) по сравнению с монотерапией НСИА. Первичная конечная точка достигнута: 3-летняя ВБИЗ составила 90,7% vs 87,6% (ОР 0,749 (95%ДИ 0,628–0,892), p 0,0006) [Hortobagyi G. et al. Ann Oncol. 2024:S0923–7534(24)04064–X]; 4-летняя ВБИЗ 88,5% vs 83,6% (ОР 0,715; 95%ДИ 0,69–0,84, p<0,0001) [Fasching P. et al. LBA13 — Ann Oncol. 2024;35 (suppl_2): 1–72].
Препарат рибоциклиб не зарегистрирован в РФ для лечения раннего рака молочной железы. Данная информация носит научный характер в целях обмена научной информацией и не является способом продвижения фармацевтического продукта.
Список литературы
- Slamon D, et al. N Eng J Med. 2024;390(12):1080-1091.
- Fasching PA, et al. ESMO 2024. LBA13 [Oral].
- https://www.fda.gov/drugs/resources-information-approved-drugs/fda-appro... (Дата последнего доступа 03.02.2025).
- European Commission. Accessed December 2, 2024. https://ec.europa.eu/transparency/documents-register/detail?ref=C(2024)8540&lang=en.
- https://docs.google.com/document/d/14XU19rSHmmg0v8aL9msY9B1uoscVK7WS/edit (Дата последнего доступа 03.02.2025).
- Barrios C, et al. ESMO Breast 2024. #600 [Oral].
- Hamilton E, et al. Impact of ribociclib dose reduction on efficacy in patients with hormone receptor–positive/human epidermal growth factor receptor 2–negative (HR+/HER2−) early breast cancer (EBC) in NATALEE. SABCS 2024. Poster presentation #P1-11-16.
11367375/RIB/web/02.25/0