По материалам публикации Rui Sun et al. Dermatol Ther (Heidelb)
https://doi.org/10.1007/s13555-024-01122-2
Ключевые сообщения статьи:
- Зачем проводилось это исследование?
- Более широкое применение секукинумаба в реальных условиях подтверждает безопасность препарата, которая наблюдась в клинических исследованиях, и демонстрирует благоприятный профиль безопасности.
- Целью данного анализа было обобщение обновленного опыта безопасности применения секукинумаба.
- Что продемонстрировало исследование?
- Риски безопасности описаны в контексте частоты нежелательных явлений, чтобы помочь в оценке соотношения пользы и рисков при назначении секукинумаба.
- Врачи, назначающие препарат, проинформированы о редких парадоксальных кожных реакциях, таких как дисгидротическая экзема и гангренозная пиодермия.
Секукинумаб представляет собой полностью человеческое моноклональное антитело против интерлейкина (IL)-17A, одобренное для лечения бляшечного псориаза от умеренной до тяжелой степени (ПСО), псориатического артрита (ПсA), аксиального спондилоартрита (аксСПА), включая анкилозирующий спондилит (АС) и нерентгенографический аксСпА, ПСО у детей, ювенильный ПсА (ЮПсА) и энтезитоассоциированный артрит (ЭАА) в более чем 100 странах1 и недавно был одобрен для лечения гнойного гидраденита (ГГ) средней и тяжелой степени2.
Модуляция провоспалительных цитокинов, включая IL-17A, с помощью биологической терапии имеет потенциальные последствия для здоровья человека, включая инфекционные заболевания и состояния, связанные с иммунитетом3,4. Из-за мультиорганных эффектов активации пути IL-17 у некоторых пациентов могут развиваться сопутствующие заболевания, усложняющие анализ причинно-следственной связи нежелательных явлений (НЯ), зарегистрированных для ингибиторов IL-17, включая секукинумаб5-8.
Опубликованы данные о безопасности применения секукинумаба в отношении злокачественных новообразований, латентного туберкулеза и воспалительных заболеваний кишечника (ВЗК)9–11. Долгосрочные 5-летние объединенные данные о безопасности были получены из 28 клинических испытаний (КИ) с участием 12 637 пациентов, а также постмаркетингового наблюдения (ПМН) в размере 285 811 пациенто-лет (ПЛ) по состоянию на 25 декабря 2018 г.12.
С 25 декабря 2018 г. по 25 июня 2022 г. постмаркетинговое наблюдение безопасности секукинумаба выросло более чем в 4 раза и составило 1 159 260 ПЛ плюс пациенты из КИ, суммарно 27 765 ПЛ. Целью данного анализа было обобщение и обновление ранее опубликованных данных о безопасности секукинумаба12.
Методы
НЯ, зарегистрированные для секукинумаба при ПМН, и объединенных КИ были рассмотрены в совокупности до 25 июня 2022 г. (если не указано иное).
- ПМН отражает мониторинг безопасности Novartis, основанный на реальных данных, который регулируется органами здравоохранения (ОЗ) и регистрируется в базе данных безопасности Novartis. О НЯ, зарегистрированных при ПМН, могли оповещать медицинские работники, пациенты, лица, осуществляющие уход, литература или социальные сети. Также включены НЯ, полученные ОЗ и отправленные в Novartis. Несмотря на то, что такие детали, как демографические данные, сопутствующие заболевания, показания к лечению и детали дозировки могли отсутствовать, все НЯ ПМН (независимо от заявленных показаний) были проанализированы.
- НЯ в КИ были объединены из 47 исследований фазы II/III/IV у взрослых, которым вводили секукинумаб в дозе 150 мг и/или 300 мг в течение как минимум 16 недель по поводу ПСО, ПсA и аксСПА. На момент прекращения сбора данных основные исследования ГГ не были доступны для объединения, но были опубликованы после прекращения сбора данных для этого отчета2. Безопасность педиатрических исследований была опубликована отдельно13, 14.
Этот анализ был направлен на оценку безопасности применения секукинумаба, прежде всего при ПМН, в сочетании с данными объединенных КИ. НЯ, связанные с оценкой безопасности, как описано в этом отчете, актуальны для секукинумаба и называются НЯ, представляющими особый интерес (НЯОИ). Кроме того, в этом отчете были описаны парадоксальные кожные реакции, выявленные при ПМН (вне КИ). Все НЯ были закодированы с использованием Международного словаря для регуляторной деятельности (MedDRA; версия 25.0) с отдельными НЯ, представленными в группе предпочтительных терминов MedDRA (PT). Поиск НЯОИ был шире, чем целевые медицинские концепции, чтобы включить все потенциальные события, например, «сыпь» включается в поиск гиперчувствительности, хотя она также может быть основным состоянием
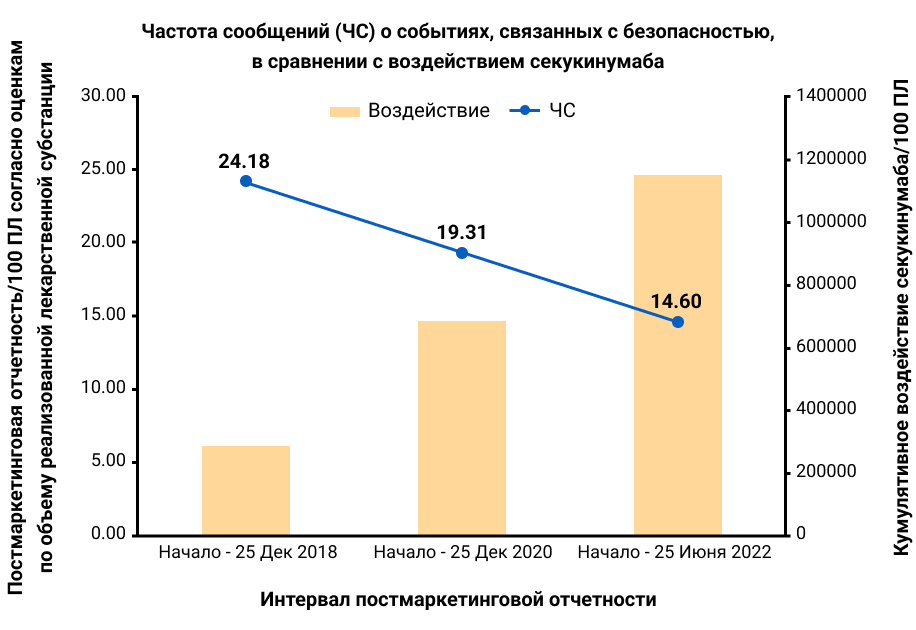
Определения НЯ и серьезных НЯ (СНЯ), критерии поиска НЯОИ, оценка постмаркетингового воздействия и описаний КИ приведены в таблице 1 и рисунке 1.
Рисунок 1. Постмаркетинговая отчетность на 100 ПЛ. График демонстрирует снижение уровня отчетности по безопасности событий (левая ось ординат) по мере увеличения кумулятивной экспозиции секукинумаба (правая ось ординат), как сообщается в периодических отчетах по безопасности от 25 декабря 2018 г., 25 декабря 2020 г. и 25 июня 2022 г. PY — ПЛ, пациенто-лет, RR — ЧС, частота сообщений.
Таблица 1. Сводные данные по безопасности полученные в ходе клинических испытаний секукинумаба (весь период лечения).
Статистический анализ
Оценки НЯ были описательными, а частота сообщений (ЧС) рассчитывалась как количество сообщений в рамках ПМН, разделенное на экспозицию препарата в этих исследованиях на 100 ПЛ. Экспозиция препарата в пстмаркетинговых наблюдениях оценивалась на основе реализованного объема лекарственной субстанции и определенной средней суточной дозе. Пул НЯ, зафиксированных в рамках КИ анализировался с использованием показателя частоты встречаемости, скорректированной на экспозицию препарата (EAIR) на 100 пациенто-лет.
Полученные результаты
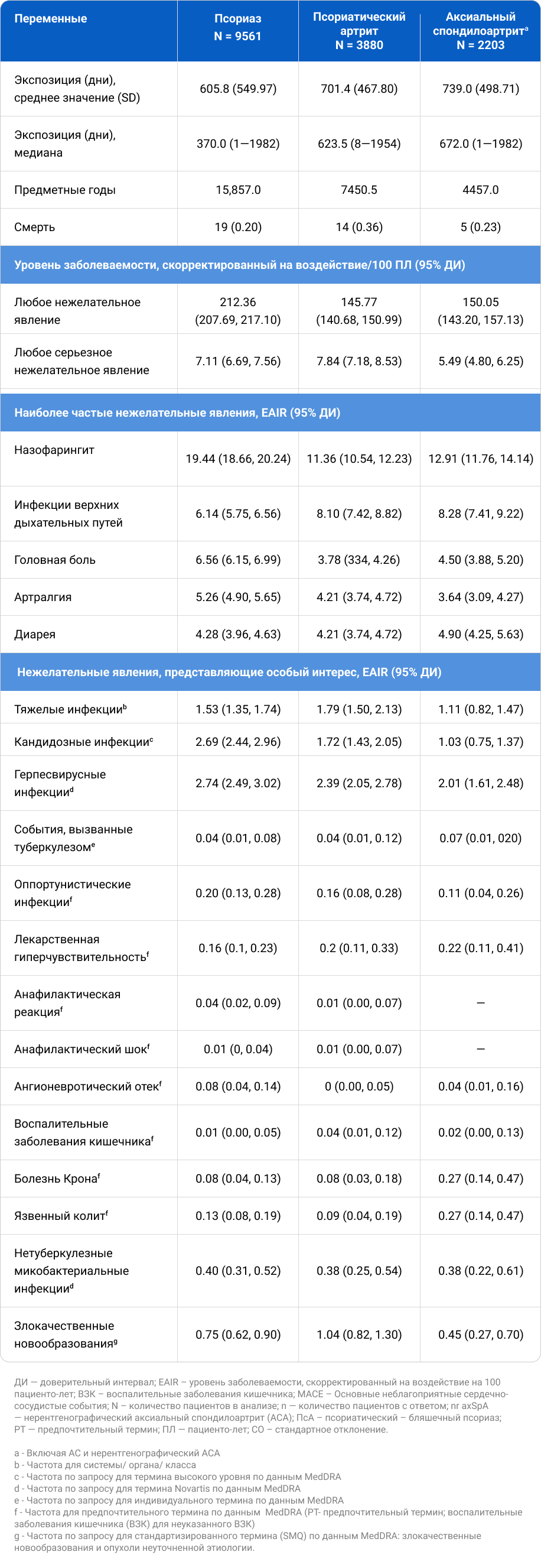
В ПМН было получено 169 248 сообщений о НЯ (ЧС 14,60/100 ПЛ, что ниже чем 24,18/100 ПЛ в декабре 2018 г., рис. 1), из них 18% были серьезными (в декабре 2018 г. серьезными были 17%). При КИ исходные характеристики пациентов суммированы в таблице 2. НЯ суммированы по показаниям, при этом длительность воздействия секукинумаба составила до 5,4 лет (таблица 1). Эти НЯ в основном были несерьезными: EAIR для НЯ по сравнению с СНЯ составлял 181,59 [95% доверительный интервал (ДИ) 178,46, 184,77]/100 ПЛ против 7,04 (95% ДИ 6,72, 7,37)/100 ПЛ. НЯОИ суммированы для ПМН и объединенных КИ в таблице 2.
Таблица 2. Сводная информация о НЯ, представляющих особый интерес в постмаркетинговых исследованиях и объединенных клинических исследованиях.
Обсуждение
Поскольку анализ данных, полученных в рамках ПМН и КИ, продемонстрировал экспозицию секукинумаба более 1 миллиона ПЛ, важно понять, остается ли пригодным сообщавшийся ранее профиль безопасности. Представленные НЯ были получены на основе более обширного постмаркетингового наблюдения и более крупного пула КИ. Большинство этих НЯ были несерьезными, как при ПМН, так и при КИ. Кроме того, хотя основные исследования по ГГ не были доступны для объединения в этом отчете, отдельно опубликованные данные по безопасности применения секукинумаба при ГГ не выявили никаких изменений в данных по безопасности2.
Периодически сообщалось об инфекционных заболеваниях при ПМН и КИ, причем в качестве наиболее распространенной патологии назывался назофарингит, серьезного инфекционного заболевания — пневмония, самой частой грибковой инфекцией — кандидоз полости рта. EAIR кандидоза была одинаковой у пациентов с диабетом и без него.
Уровень смертности от COVID-19 составил 1,4%, что сопоставимо с фоновым уровнем смертности от COVID (1,1%) в США15. Повышенного риска заражения COVID-19 не выявлено. Клинически значимые грибковые, герпесные, микобактериальные или стафилококковые инфекции оставались редкими, сообщения о них были ограниченными или противоречивыми, что исключало достоверные выводы. По данным метаанализа, частота развития оппортунистических инфекций была одинаковой у пациентов с секукинумабом и иксекизумабом, но была ниже, чем у бимекизумаба16.
Явления гиперчувствительности через 2 недели применения секукинумаба не могли быть вызваны секукинумабом, если только они не были IgE-опосредованными. При ПМН 70% случаев с известными датами начала заболевания наблюдались спустя 2 недели после начала приема секукинумаба. Не IgE-опосредованные явления (на основании описанных событий) были редкими, без доказательств связи с секукинумабом. Случаи анафилаксии были редкими.
ВЗК анализировались ранее на основе 21 объединенного КИ по трем показаниям (ПСО, ПсA и аксСПА) до 25 июня 2017 г., среди них отмечались язвенный колит (EAIR до 0,2/100 ПЛ), болезнь Крона (EAIR до 0,4/100 ПЛ) и неуточненные ВЗК (EAIR до 0,1/100 ПЛ). Из всех пациентов с ВЗК 30 были впервые выявленными; у 11 пациентов отмечались обострения ВЗК, что составляет 23% из 48 пациентов с ВЗК в анамнезе, т. е. у 37 (77%) пациентов с ВЗК в анамнезе обострения ВЗК не наблюдалось11. В текущем анализе, представленном в таблице 1, EAIR для ВЗК были либо аналогичны, либо ниже, чем сообщалось ранее. Совокупные данные КИ также подтвердили, что 76% пациентов с ВЗК в анамнезе не сообщали об обострениях ВЗК. Кроме того, EAIR ВЗК для секукинумаба сопоставим с показателями ВЗК, зарегистрированными в общих популяциях ПСО, ПсA и аксСПА17-19, хотя отмечаются различия в методологиях сбора и анализа данных между КИ и обсервационными исследованиями, что может препятствовать прямому сравнению.
Другой целевой мониторинг безопасности включал злокачественные новообразования, реактивацию вируса гепатита В (HBV), основные неблагоприятные сердечно-сосудистые события (MACE) и суицидальные мысли и поведение (SIB). В отчетах о ПМН одна четверть случаев злокачественных новообразований с указанными датами начала (9% всех случаев злокачественных новообразований при ПМН) возникла в течение 6 месяцев после начала приема секукинумаба, что может указывать на то, что секукинумаб не был причинным фактором20. Уровень злокачественности EAIR в объединенных КИ для секукинумаба сопоставим с показателями, зарегистрированными в других КИ для ингибиторов IL-17A (иксекизумаб и бродалумаб)21,22. Соответствующие факторы риска обычно присутствовали при сообщении о HBV, MACE и SIB при ПМН. В КИ также часто встречались основные сердечно-сосудистые или метаболические заболевания. Реактивация HBV у одного пациента не повторилась после возобновления лечения секукинумабом одновременно с противовирусной профилактикой, что демонстрирует нам важность снижения риска неблагоприятных результатов. Во время ПМН были выявлены парадоксальные кожные реакции. О гангренозной пиодермии (ГП) сообщалось только у одного пациента, принимавшего участие в КИ. Ввиду своей редкости частота возникновения ГП может не определяться. Псориаз преимущественно обусловлен Т-хелперными клетками 17 (Th17), тогда как атопический дерматит в основном обусловлен клетками Th2. Когда клетки Th17 ингибируются, баланс может сместиться в сторону клеток Th2, что приводит к парадоксальной экзематозной реакции. Парадоксальные псориазоформные и экзематозные высыпания были идентифицированы как наиболее распространенный тип парадоксальных реакций и ранее были связаны с воздействием ингибиторов фактора некроза опухоли-а (91,2% всех случаев), ингибиторов IL-17A/17R (3,5%), IL-17R (3,5%), IL-4R-a (2,7%), IL-12/23 (2,4%) и IL-23 (0,01%)23.
Ограничения данных ПМН включают недостаточную информацию, отсутствие поправок на искажающие факторы, неподтвержденные с медицинской точки зрения источники данных и дублирующиеся отчеты. Более низкая ЧС при ПМН может быть результатом недавней пандемии COVID-19, которая привела к ограничению доступа к медицинским работникам и сокращению сообщений о НЯ24. Кроме того, ЧС ПМН не эквивалентна EAIR при КИ, учитывая различия в надежности зарегистрированных случаев (числитель) и общего риска в популяции (знаменатель). Несмотря на эти ограничения, мониторинг ЧС на протяжении многих лет дает представление о профилях безопасности с течением времени. Данные ПМН также служат эффективным механизмом для постоянного мониторинга безопасности и выявления новых результатов безопасности, которые не наблюдались при оценке КИ из-за ограниченных размеров выборки по сравнению с постмаркетинговыми данными.
Заключение
Данный анализ показал, что профиль безопасности в постмаркетинговых исследованиях с более, чем миллионом пациенто-лет воздействия, соответствовал профилю безопасности секукинумаба, который наблюдался в возросшем пуле клинических испытаний в различных популяциях дерматологических и ревматологических пациентов. Кроме того, в рутинных постмаркетинговых исследованиях у кумулятивных пациентов, получавших секукинумаб, были выявлены с очень низкой частотой парадоксальные кожные реакции, которые по своей природе не меняют ранее установленный баланс пользы и риска применения секукинумаба.
Список литературы
- Secukinumab Summary of Product Characteristics (SmPC). Basel: Novartis Pharma AG.
- Kimball AB, Jemec GBE, Alavi A, Reguiai Z, Gottlieb AB, Bechara FG, et al. Secukinumab in moderate-tosevere hidradenitis suppurativa (SUNSHINE and SUNRISE): week 16 and week 52 results of two identical, multicentre, randomised, placebo-controlled, double-blind phase 3 trials. Lancet. 2023;401:747–61.
- Winthrop KL, Mariette X, Silva JT, Benamu E, Calabrese LH, Dumusc A, et al. ESCMID Study Group for Infections in Compromised Hosts (ESGICH) Consensus Document on the safety of targeted and biological therapies: an infectious diseases perspective (Soluble immune effector molecules [II]: agents targeting interleukins, immunoglobulins and complement factors). Clin Microbiol Infect. 2018;24(Suppl 2):S21-s40.
- Waldron JL, Schworer SA, Kwan M. Hypersensitivity and immune-related adverse events in biologic therapy. Clin Rev Allergy Immunol. 2022;62: 413–31.
- Takeshita J, Grewal S, Langan SM, Mehta NN, Ogdie A, Van Voorhees AS, et al. Psoriasis and comorbid diseases: epidemiology. J Am Acad Dermatol. 2017;76:377–90.
- Rodrı´guez-Zu´n˜iga MJM, Garcı´a-Perdomo HA. Systematic review and meta-analysis of the association between psoriasis and metabolic syndrome. J Am Acad Dermatol. 2017;77:657-66.e8.
- Caso F, Chimenti MS, Navarini L, Ruscitti P, Peluso R, Girolimetto N, et al. Metabolic syndrome and psoriatic arthritis: considerations for the clinician. Expert Rev Clin Immunol. 2020;16:409–20.
- Mintoff D, Benhadou F, Pace NP, Frew JW. Metabolic syndrome and hidradenitis suppurativa: epidemiological, molecular, and therapeutic aspects. Int J Dermatol. 2022;61:1175–86.
- Lebwohl M, Deodhar A, Griffiths CEM, Menter MA, Poddubnyy D, Bao W, et al. The risk of malignancy in patients with secukinumab-treated psoriasis, psoriatic arthritis and ankylosing spondylitis: analysis of clinical trial and postmarketing surveillance data with up to five years of follow-up. Br J Dermatol. 2021;185:935–44.
- Elewski BE, Baddley JW, Deodhar AA, Magrey M,Rich PA, Soriano ER, et al. Association of secukinumab treatment with tuberculosis reactivation in patients with psoriasis, psoriatic arthritis, or ankylosing spondylitis. JAMA Dermatol. 2021;157: 43–51.
- Schreiber S, Colombel JF, Feagan BG, Reich K, Deodhar AA, McInnes IB, et al. Incidence rates of inflammatory bowel disease in patients with psoriasis, psoriatic arthritis and ankylosing spondylitis treated with secukinumab: a retrospective analysis of pooled data from 21 clinical trials. Ann Rheum Dis. 2019;78:473–9.
- Gottlieb AB, Deodhar A, McInnes IB, Baraliakos X, Reich K, Schreiber S, et al. Long-term safety of secukinumab over five years in patients with moderate-to-severe plaque psoriasis, psoriatic arthritis and ankylosing spondylitis: update on integrated pooled clinical trial and post-marketing surveillance data. Acta Derm Venereol. 2022;102: adv00698.
- Sticherling M, Nikkels AF, Hamza AM, Kwong P, Szepietowski JC, El Sayed M et al. Secukinumab in pediatric patients with plaque psoriasis: pooled safety analysis from two phase 3 randomized clinical trials. Am J Clin Dermatol. 2023.
- Brunner HI, Foeldvari I, Alexeeva E, Ayaz NA, Calvo Penades I, Kasapcopur O, et al. Secukinumab in enthesitis-related arthritis and juvenile psoriatic arthritis: a randomised, double-blind, placebo-controlled, treatment withdrawal, phase 3 trial. Ann Rheum Dis. 2023;82:154–60.
- Mortality Analyses. https://coronavirus.jhu.edu/data/mortality2023.
- Vassilopoulos A, Shehadeh F, Benitez G, Kalligeros M, Cunha JS, Cunha CB, et al. The incidence of opportunistic infections in patients with psoriatic arthritis treated with biologic and targeted synthetic agents: a systematic review and meta-analysis. Front Pharmacol. 2022;13: 992713.
- Eppinga H, Poortinga S, Thio HB, Nijsten TEC, Nuij V, van der Woude CJ, et al. Prevalence and phenotype of concurrent psoriasis and inflammatory bowel disease. Inflamm Bowel Dis. 2017;23:1783–9.
- Pittam B, Gupta S, Harrison NL, Robertson S, Hughes DM, Zhao SS. Prevalence of extra-articular manifestations in psoriatic arthritis: a systematic review and meta-analysis. Rheumatology (Oxford). 2020;59:2199–206.
- Stolwijk C, van Tubergen A, Castillo-Ortiz JD, Boonen A. Prevalence of extra-articular manifestations in patients with ankylosing spondylitis: a systematic review and meta-analysis. Ann Rheum Dis. 2015;74:65–73.
- Howard J. Minimum latency & types or categories of cancer. 2014.
- Genovese MC, Mysler E, Tomita T, Papp KA, Salvarani C, Schwartzman S, et al. Safety of ixekizumab in adult patients with plaque psoriasis, psoriatic arthritis and axial spondyloarthritis: data from 21 clinical trials. Rheumatology (Oxford). 2020;59:3834–44.
- Reich K, Thac¸i D, Stingl G, Andersen JS, Hiort LC, Lexner MO, et al. Safety of brodalumab in plaque psoriasis: integrated pooled data from five clinical trials. Acta Derm Venereol. 2022;102: adv00683.
- Murphy MJ, Cohen JM, Vesely MD, Damsky W. Paradoxical eruptions to targeted therapies in dermatology: a systematic review and analysis. J Am Acad Dermatol. 2022;86:1080–91.
- Ragavan MV, Legaspi N, LaLanne A, Hong JC, Small EJ, Borno HT. Analysis of serious adverse eventreporting for patients enrolled in cancer clinical trials during the COVID-19 pandemic. JAMA Oncol. 2022;8:1849–51.
433175/SEC/DIG/04.24/0