Cross AL, Hawkes J, Frankland H. et al. Neutrophil function following treatment of psoriatic arthritis patients with secukinumab: altered cytokine signalling but no impairment of host defence. Rheumatology (Oxford). 2023 Sep 1;62(9):3025-3034. doi: 10.1093/rheumatology/kead007.
Ключевые сообщения:
- Лечение секукинумабом достоверно снижает активность заболевания у пациентов с псориатическим артритом.
- Лечение секукинумабом пациентов с псориазом не изменяло функции нейтрофилов, связанные с защитой хозяина от инфекций.
- Секукинумаб приводил к изменениям транскриптома циркулирующих нейтрофилов, что имеет отношение к влиянию на передачу сигналов цитокинов in vivo.
Введение
Псориатический артрит (ПсА) — хронический воспалительный артрит, который развивается у 15–20% больных псориазом. Помимо поражения суставов, внесуставные проявления и коморбидности являются важными терапевтическими задачами1-3. Раннее выявление, а также своевременная диагностика и эффективное лечение имеют решающее значение для предотвращения инвалидности.
С иммунологической точки зрения в патофизиологии ПсА ключевую роль играет дисфункция оси IL–23/174. Это привело к разработке таргетных методов лечения, которые избирательно ингибируют/блокируют эти цитокины. Примером такого препарата является секукинумаб, полностью человеческое моноклональное антитело, нейтрализующее IL–17A5-8. Секукинумаб, лицензированный для применения при псориазе и ПсА, эффективен при лечении этих состояний, имеет множество преимуществ по сравнению как с традиционными DMARD (метотрексатом и лефлуномидом), так и с биологической терапией ингибиторами ФНО9-12.
Ингибирование специфических цитокинов в терапевтических целях потенциально может не только модулировать иммунную систему в необходимом терапевтическом направлении, но и спровоцировать нежелательные побочные эффекты, например реактивировать латентный туберкулез, как в случае с лечением анти-ФНО13, 14. Поэтому важно исследовать взаимодействие цитокинов, их ингибиторов и клеток иммунной системы не только in vitro, но и in vivo, у пациентов с заболеванием, получающих специфическую цитокин-блокирующую терапию15, 16.
Нейтрофилы помимо своей основной роли в защите от микробных инфекций, также могут способствовать провоспалительным реакциям и способствовать повреждению собственных тканей при ряде воспалительных состояний17, 18. Их роль в воспалении традиционно связана с высвобождением повреждающих ткани молекул — активных форм кислорода (АФК), гранулярных ферментов19, а также с их способностью генерировать и высвобождать ряд провоспалительных цитокинов и хемокинов19, 20. При ревматоидном артрите (РА) многие внутриклеточные маркеры активации нейтрофилов, такие как активация ядерного фактора (NF)-jB, повышаются при активном заболевании, но возвращаются к своему нормальному уровню во время успешно проведенного лечения 21, 22. Следовательно, измерение нейтрофилов крови при воспалительных заболеваниях может указывать на механизмы активации in vivo, а также может сообщать об изменениях активности заболевания23. При псориазе клетки Th17 проникают в ткани и производят IL–17A, который действует на кератиноциты24 с образованием цитокинов и хемокинов, включая IL–8 и хемокиновый (CC-мотив) лиганд 20 (CCL20)25. IL–8 (CXCL8) является мощным хемоаттрактантом нейтрофилов и приводит к инфильтрации нейтрофилами поврежденной кожи26, тогда как CCL20 является хемоаттрактантом нейтрофилов и клеток Th1727, 28. Увеличение количества клеток Th17 в синовиальной жидкости и тканях суставов при ПсА и продукции IL–17 Т-клетками при энтезите подчеркивает, что аналогичные процессы происходят при заболеваниях суставов4. Сами активированные нейтрофилы могут экспрессировать CCL2 и CCL20, которые являются хемоаттрактантами для клеток Th17, кроме того, клетки Th17 могут экспрессировать CXCL8, образуя таким образом сложную взаимно влияющую сеть активации-амплификации28. В патогенезе псориаза центральная роль принадлежит ил-17А, блокада которого лежит в основе таргетного лечения, например препаратом секукинумаб который показал свою эффективность в ряде клинических исследований7.
Целью данного исследования было изучение функций нейтрофилов крови у пациентов с ПсА до и после лечения секукинумабом, а также корреляция функциональных показателей с клиническими исходами и у здоровых людей. В исследовании принимали участие 19 пациентов с активным ПсА, получавшие секукинумаб. Клинический ответ (критерии ответа на ПсА (PsARC) и индекс площади и тяжести псориаза (PASI)) и функции нейтрофилов периферической крови (апоптоз, экспрессия рецепторов, фагоцитоз/убийство, хемотаксис и экспрессия РНК) измерялись с интервалом в 12 недель в течение 48 недель и сравнивались со здоровыми людьми соответствующего возраста и пола.
Методы
В исследовании принимали участие 19 пациентов с активным ПсА, получавшие секукинумаб, 3 пациента позднее выбыли из исследования в разное время и были исключены из оценки его результатов. Пациенты получали секукинумаб в дозировке 150 или 300 мг подкожно один раз в неделю в течение первых 4 недели; пациенты с умеренным и тяжелым псориатическим поражением кожи получали 300 мг. Введение секукинумаба в дозировке 150 или 300 мг (в соответствии со стандартной практикой) с интервалом в 4 недели продолжалось до 48 недель в зависимости от тяжести кожных проявлений.
Ответ на лечение оценивали с 12-недельными интервалами с использованием критериев ответа на ПсА (PsARC) по сравнению с показателями до лечения29. Кожный ответ оценивался с интервалом в 12 недель с учетом распространенности псориатических поражений и индекса тяжести (PASI): кожный ответ определялся как 90% снижение показателя PASI (PASI90) по сравнению с состоянием кожи до лечения.
Образцы крови брали исходно, а также на 12, 24 и 48 неделе исследования. Активность заболевания по PsARC, PASI75 и 90, а также улучшение критериев ACR на 20% (ACR20) оценивались исходно и каждые 12 недель. Кроме того, кровь была взята у 10 здоровых людей, соответствовавших когорте пациентов по возрасту и полу.
Образцы крови собирали в литий-гепариновые вакутейнеры, нейтрофилы выделяли после седиментации в HetaSep и центрифугирования на Фиколл-Паке30; загрязняющие эритроциты удаляли путем гипотонического лизиса. Нейтрофилы проверяли на чистоту окрашиванием по Романовскому, а также путем микроскопического анализа цитоспинов, жизнеспособность оценивалась с помощью исключения синего трипана; это были >97% и >98%, соответственно, в свежевыделенных клетках. Функции нейтрофилов измерялись у пациентов, получавших секукинумаб, исходно и через 12, 24 и 48 недель после терапии и и сравнивались со здоровыми людьми соответствующего возраста и пола. Гранулоциты низкой плотности измерялись во фракции мононуклеарных клеток периферической крови (PBMC) после центрифугирования Ficoll-Paque, как описано ранее31.
Полученные результаты
Апоптоз
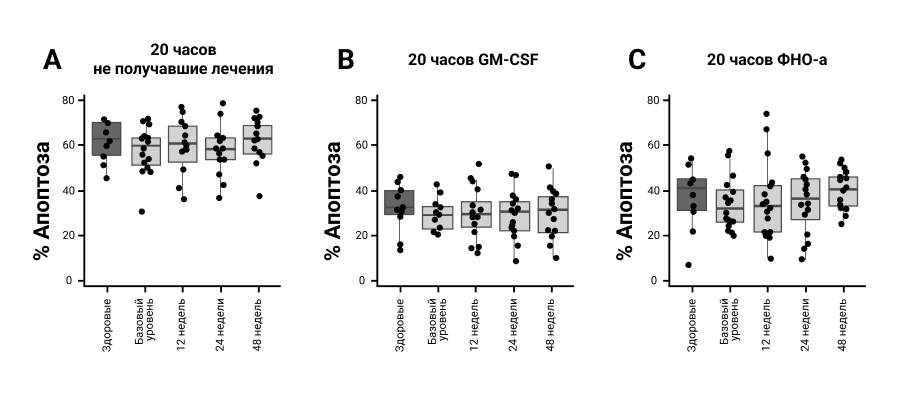
На рис. 1А показано, что исходно 57% (SD 10) нейтрофилов ПсА подверглись апоптозу после 20 часов культивирования in vitro, что немного ниже, чем показатели, наблюдаемые у здоровых контрольных нейтрофилов, инкубированных в идентичных условиях [62% (SD 9)]. Однако эти различия не достигли статистической значимости (Р<0,3). Гранулоцитарно-макрофагальный колониестимулирующий фактор (GM–CSF) (рис. 1B) и ФНО-a (рис. 1C) замедляют этот конститутивный апоптоз в течение 20 часов в культуре и этот цитокин-замедленный апоптоз был немного ниже у пациентов с ПсА, но не был статистически значимым (P = 0,34 и 0,57 для замедленного апоптоза GM–CSF и ФНО-a, соответственно). Как конститутивный, так и цитокин-замедленный апоптоз нейтрофилов ПсА существенно не отличался от такового у здоровых людей через 12, 24 и 48 недель лечения. Более низкие уровни апоптоза, зарегистрированные на исходном уровне, увеличивались при лечении с течением времени и соответствовали уровням у здоровых людей (рис. 1A-C).
АФК и фагоцитоз
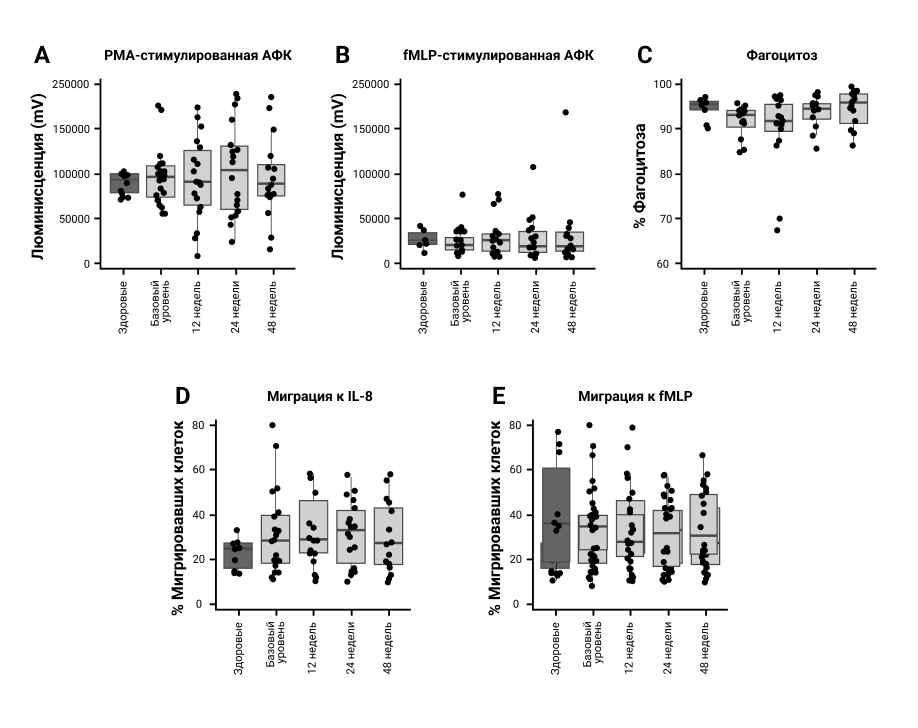
PMA-стимулированная (рис. 2A) или fMLP-стимулированная (рис. 2B) продукция АФК нейтрофилами ПсА существенно не отличалась от продукции у здоровых людей в контрольной группе. Наблюдалась тенденция к увеличению продукции АФК после терапии, но она не была статистически значимой. Аналогично, не было различий в способности нейтрофилов ПсА до или после лечения фагоцитировать опсонизированный сывороткой S. aureus по сравнению с фагоцитозом здоровых людей (рис. 2C).
Хемотаксис
Хемотаксис нейтрофилов по отношению к IL–8 был исходно несколько повышен по сравнению с уровнями здоровых нейтрофилов контрольной группы (рис. 2D), но это не достигал статистической значимости (P=0,3). Хемотаксис IL–8 существенно не менялся во время лечения. Хемотаксис по отношению к fMLP нейтрофилов у пациентов на исходном уровне был аналогичен таковому у здоровых людей (рис. 2E), что указывает на отсутствие общего увеличения хемотаксической способности нейтрофилов PsA; небольшое увеличение хемотаксиса в сторону IL–8 может быть следствием сенсибилизации к этому хемокину in vivo. Никаких существенных изменений в хемотаксисе нейтрофилов после терапии у пациентов с ПсА не наблюдалось.
Рисунок 1. Апоптоз нейтрофилов после лечения секукинумабом. Пробы крови брали при указанных визитах у каждого пациента или здорового человека из контрольной группы (КГ) (n=16 и n=10 соответственно). Изолированные нейтрофилы инкубировали в течение 20 часов (стандартное отклонение 1 час) в отсутствие (А) или присутствии (В) GM–CSF (при 50 нг/мл) и (С) ФНО-a (при 10 нг/мл). После инкубации клетки дважды окрашивали аннексином V Alexa Fluor 488 и PI для измерения уровней апоптоза методом проточной цитометрии. Всего было проанализировано 10 000 событий/образец.
Рисунок 2. Функции нейтрофилов после лечения секукинумабом. Пробы крови брали при указанных визитах у каждого пациента или здорового человека из контрольной группы (n=16 и n=10 соответственно). Свежевыделенные нейтрофилы инкубировали в присутствии люминола и стимулировали (А) РМА (0,1 мг/мл, рецептор-независимый) или (В) fMLP (1 мМ, рецептор-зависимый). (C) Свежевыделенные нейтрофилы инкубировали в течение 30 минут с убитым нагреванием, меченным PI, опсонизированным S. aureus в соотношении 1:10 перед анализом методом проточной цитометрии. Нейтрофилы помещали в транслуночную систему с порами диаметром 3 мм и инкубировали в течение 90 минут, чтобы обеспечить активную миграцию к известным хемоаттрактантам нейтрофилов: (D) IL–8 (при 100 нг/мл) или (E) fMLP (0,1 нМ). Мигрировавшие клетки подсчитывали с помощью счетчика Коултера и определяли как процент клеток, перемещающихся в сторону хемоаттрактанта.
Экспрессия рецепторов
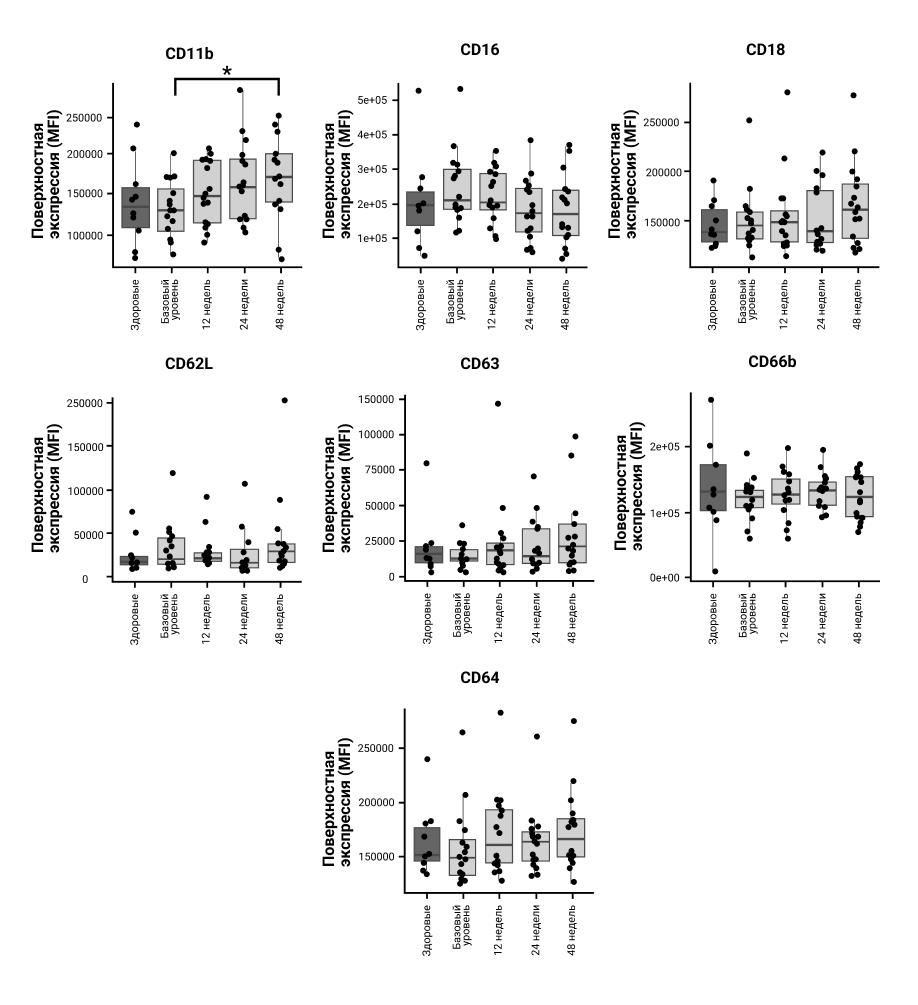
Уровни экспрессии всех проанализированных рецепторов существенно не отличались в нейтрофилах ПсА на исходном уровне по сравнению с контрольной группой (рис. 3). Во время терапии уровни экспрессии CD11b, CD18 и CD63 незначительно повышались, но через 48 недель после терапии только уровни CD11b были значительновыше исходного уровня (P 0,021). Кроме того, поверхностные уровни CD16 снизились во время терапии, но это снижение не достигло статистической значимости
(P 0,08 через 24 недели по сравнению с исходным уровнем). Эти наблюдения указывают на медленную, прогрессирующую активацию циркулирующих нейтрофилов во время терапии.
Гранулоциты низкой плотности (LDG)
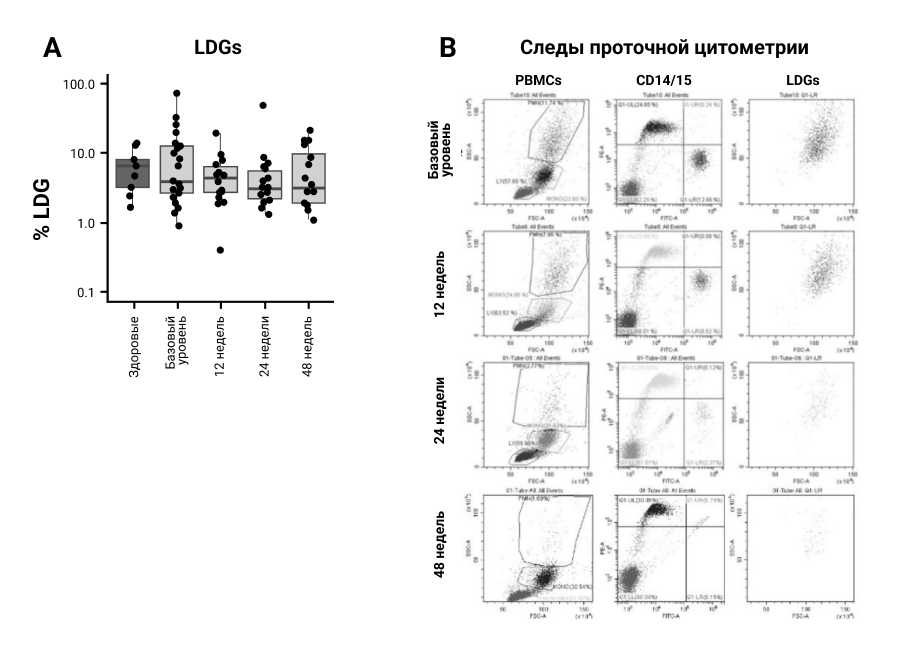
Исходно средние значения LDG (% от общего количества клеток в слое PBMC) в крови пациентов с ПсА были повышены по сравнению со здоровыми людьми из контрольной группы (рис. 4А). Среднее значение для здоровых людей из контрольной группы составило 6,5%, что соответствует предыдущим наблюдениям31, тогда как среднее значение для пациентов с ПсА составило 11,4% (SD 4,2), но не было значимым (P 0,39). Однако во время терапии средние уровни LDG снизились до исходного уровня через 48 недель после лечения, включая пациента с высоким уровнем LDG на исходном уровне (рис. 4Б). Никаких необычных клинических явлений у пациентов с исходными более высокими уровнями LDG не наблюдалось.
Изменения транскриптома нейтрофилов ПсА после лечения секукинумабом
Анализ главных компонентов (PCA) транскриптомов нейтрофилов показал разделение образцов до и после терапии секукинумабом (рис. 5А). Статистический анализ с помощью EdgeR выявил, что секукинумаб значительно снижает экспрессию 394 генов, одновременно повышая экспрессию 681 гена (FDR < 0,05) через 12 недель после терапии. Хотя IL–17A и IL–17F не экспрессировались нейтрофилами PsA, экспрессия мРНК ассоциированного с псориазом хемокина CXCL10 снизилась, тогда как экспрессия CCL4L1 увеличилась после 12 недель терапии секукинумабом. IPA показал, что сигнальные пути, связанные с передачей сигналов IL–8, toll-подобных рецепторов и апоптоза значительно подавляются секукинумабом (рис. 5B). Пути повышенной регуляции включали передачу сигналов EIF2, фактора ингибирования миграции макрофагов и протеинкиназы А. IPA также использовался для прогнозирования регулирующих факторов, стоящих перед экспрессией генов, то есть факторов транскрипции и внеклеточных цитокинов, которые ингибировались или активировались терапией секукинумабом. Было предсказано, что активация генов в ответ на IL–1A, онкостатин М и тромбопоэтин будет ингибироваться секукинумабом (FDR <0,05). Среди транскрипционных факторов присутствовали NF-jB, IKK-b и Янус-киназа 2 и предполагалось, что киназы будут ингибироваться секукинумабом. Эти анализы показывают, что секукинумаб вызывает дифференциальные изменения в функциях нейтрофилов крови, при этом некоторые сигнальные/транскрипционные пути активируются, а другие избирательно подавляются.
Изменения транскриптома нейтрофилов ПсА по сравнению со здоровыми людьми
Мы сравнили экспрессию генов у пяти пациентов с ПсА до терапии и у пяти здоровых людей из контрольной группы. PCA показал четкое разделение двух когорт (рис. 5C), при этом 6049 генов значительно различались у пациентов с ПсА и у здоровых людей из контрольной группы (на 3754 выше при ПсА, на 2295 выше у здоровых, EdgeR FDR <0,05). Экспрессия IL–23a и IL–15 была выше при ПсА (FDR <0,05). Сигнальные пути, более высокие у пациентов с ПсА, включали передачу сигналов рецептора смерти, Rac, PI3K/AKT и активацию NF-jB (рис. 5D, E). У здоровых людей в контрольной группе передача сигналов IL–8, передача сигналов интегрина и FccR-опосредованный фагоцитоз были повышены по сравнению с нейтрофилами Пс А. Вышестоящие цитокины, которые, по прогнозам, будут регулировать экспрессию генов нейтрофилов при ПсА, включали CSF2 (G-CSF), CD40LG, онкостатин M, IFN-c и a и ФНО-a (FDR <0,05). Было предсказано, что несколько киназных комплексов будут активны в нейтрофилах PsA, включая FLT1, NF-jB и EIF2AK2 (FDR <0,05). Передача сигналов через CDK19 и CDKN1A была выше в нейтрофилах здоровых людей из контрольной группы.
Рисунок 3. Экспрессия поверхностных рецепторов нейтрофилов после лечения секукинумабом. Пробы крови брали при указанных визитах у каждого пациента или здорового человека из контрольной группы (n=16 и n=10 соответственно). Свежевыделенные нейтрофилы окрашивали указанными конъюгированными антителами и анализировали с использованием проточного цитометра Cytoflex. Всего было проанализировано 10 000 событий/образец.
Рисунок 4. LDG в крови больных Пс А. Пробы крови брали при указанных визитах у каждого пациента или здорового человека из контрольной группы (n=16 и n=10 соответственно). Слой PBMC градиента плотности Ficoll-Paque удаляли и промывали, а клетки окрашивали на CD14/CD15 и анализировали с помощью проточной цитометрии. Клетки, измеренные у нейтрофильных ворот, были названы LDG и подтверждены двойным окрашиванием как CD15high/CD14low. (A) Средние значения LDG, измеренные в крови здоровых людей (КГ) и пациентов в указанные моменты времени после лечения секукинумабом. (B) Процедура гейтирования и окрашивания для количественной оценки LDG и изменений LDG во время терапии.
Обсуждение
Функция нейтрофилов изменяется при воспалительных состояниях, и их функциональные изменения либо отражают, либо приводят к изменениям активности заболевания17,18. Мы измерили функции нейтрофилов крови у пациентов с ПсА и определили, изменилась ли она по сравнению с нейтрофилами крови здоровых людей из контрольной группы; появились ли изменения после лечения секукинумабом и коррелируют ли они с изменениями активности заболевания после применения секукинумаба. Мы измерили функции нейтрофилов, связанные с защитой хозяина от инфекций (апоптоз, способность генерировать АФК, экспрессию поверхностных рецепторов и хемотаксис) и изменения в их транскриптомах, которые могут идентифицировать пути передачи сигнала, ответственные за активацию in vivo, и выявить, как эти клетки реагируют и экспрессируют регуляторные цитокины/хемокины.
Все 16 пациентов с ПсА хорошо отреагировали на лечение. У 75% был продемонстрирован ответ PsARC через 12 недель, а у 100% - через 36 недель, с сопоставимым улучшением показателей кожи: у всех наблюдались клинические признаки снижения активности заболевания на протяжении всего исследования. За период исследования не было зарегистрировано никаких серьезных побочных эффектов. Важно отметить, что случаев инфекций зарегистрировано не было, что указывает на то, что лечение секукинумабом не оказало неблагоприятного воздействия на защиту хозяина от инфекций. Измерения функции нейтрофилов in vitro подтверждают эти наблюдения. Мы не обнаружили никаких функциональных изменений, которые значительно отличались бы от таковых в нейтрофилах крови здоровых людей из контрольной группы, которые могли бы повлиять на защиту хозяина. Тем не менее, мы наблюдали различия в транскриптомах нейтрофилов крови пациентов с исходным ПсА и здоровых людей из контрольной группы, а также в нейтрофилах пациентов с ПсА до и после терапии, что, вероятно, отражает изменения в передаче сигналов цитокинов/хемокинов во время активного заболевания и при пост-терапии после блокирования сигнальной сети IL–17A.
Рисунок 5. Анализ данных транскриптома нейтрофилов при ПсА (n = 5 до и через 12 недель после применения секукинумаба) и нейтрофилов здоровых людей из контрольной группы (n = 5). (A) Разделение транскриптомов нейтрофилов ПсА до и после терапии секукинумабом с использованием PCA. (B) Сигнальные пути подавляются секукинумабом (прогноз IPA). (C) Разделение транскриптомов нейтрофилов при ПсА и у здоровых людей из контрольной группы с использованием PCA. (D) Активация сигнальных путей в нейтрофилах ПсА (предсказание IPA). (E) Сигнальный путь рецептора смерти был повышен в нейтрофилах ПсА по сравнению со здоровыми людьми из контрольной группы (красный, повышенная регуляция; зеленый, пониженная регуляция; белый, отсутствие значительных изменений в экспрессии)
Данные наблюдения показывают, что любые различия в системных уровнях цитокинов/хемокинов при ПсА были недостаточными, чтобы отрицательно повлиять на способность нейтрофилов осуществлять свою защитную деятельность. Уровни поверхностной экспрессии CD11b и CD18 увеличились, тогда как поверхностные уровни CD16 в нейтрофилах при ПсА во время терапии снизились по сравнению со здоровыми людьми из контрольной группы, что снова указывает на активацию in vivo.
Экспрессия генов нейтрофилов может избирательно повышаться или понижаться при воздействии провоспалительных медиаторов in vitro32, а также в крови пациентов с воспалительными заболеваниями20. Действительно, транскриптомное профилирование нейтрофилов крови у пациентов с РА до начала лечения может разделить пациентов на тех, кто будет и не будет реагировать на терапию ингибиторами ФНО33. Поэтому мы описали транскриптомы нейтрофилов крови пяти пациентов с ПсА до и через 12 недель после терапии, чтобы определить, изменился ли у них профиль транскриптома во время активного заболевания, а также во время лечения секукинумабом. Эти анализы подтверждают сложные изменения в статусе активации нейтрофилов до и после терапии, при этом некоторые метаболические пути (например, передача сигналов клетками, передача сигналов опосредованная хемокинами, хемотаксис) подавляются во время терапии. Примечательно, что секукинумаб значительно подавлял активность CXCL10, что соответствует предыдущим наблюдениям ингибирования IL–17 при псориазе34. Однако несколько путей, связанных с трансляцией, катаболизмом мРНК и инициацией трансляции, были активированы. Хотя мы не обнаружили экспрессию IL–17A или IL–17F нейтрофилами PsA, в соответствии с предыдущими данными35, 36 мы наблюдали более высокую экспрессию IL–23a и IL–15. Экспрессия в нейтрофилах ПсА (FDR <0,05). Эти два цитокина действуют синергически, индуцируя продукцию IL–17A и IL–17F с помощью кожных лимфоцит-ассоциированных антиген-положительных Т-клеток у пациентов с псориазом37.
Эти объединенные данные указывают на то, что во время терапии происходит сложная регуляция функции циркулирующих нейтрофилов с увеличением метаболических путей (включая изменения экспрессии рецепторов) и снижением других (сигнальные пути рецепторов). Также возможно, что если местное производство IL–8 кератиноцитами снижается за счет ингибирования IL–17, то меньшее количество нейтрофилов покинет кровяное русло, следовательно, в нем может циркулировать большее количество активированных нейтрофилов. В параллельной серии экспериментов нам не удалось обнаружить какого‑либо воздействия IL–17A на высокоочищенные нейтрофилы здоровых доноров in vitro. Таким образом, мы пришли к выводу, что изменения, наблюдаемые в циркулирующих нейтрофилах после блокады IL–17, являются опосредованными через снижение экспрессии цитокинов и хемокинов, активирующих нейтрофилы (IL–8 (CXCL8) и CCL20). Предыдущая работа показала снижение экспрессии CXCL8 и CCL20 при псориатических поражениях кожи после блокады IL–1734.
LDG представляют собой недавно идентифицированную субпопуляцию нейтрофилов, которая сохраняется в верхнем слое, содержащем РВМС, после седиментации Фиколл-Пака37. LDG имеют измененные паттерны экспрессии рецепторов и генов, а также другие функциональные свойства по сравнению с нейтрофилами нормальной плотности31. Мы обнаружили исходное повышение количества LDG у некоторых пациентов с ПсА и уменьшение количества этих клеток во время терапии. Однако мы не смогли выявить каких‑либо клинических особенностей у пациентов с высоким исходным количеством LDG.
Потенциальные ограничения этого исследования включают его проспективный дизайн и возможность искажающего воздействия других препаратов. Существует вероятность того, что наблюдаемые изменения в нейтрофилах при ПсА могли произойти из-за уменьшения системного воспаления. Чтобы смягчить потенциальное воздействие других препаратов, до достижения первичной конечной точки не допускались никакие изменения в лекарственной терапии. Оба ограничения могут быть изучены в более крупном рандомизированном контролируемом исследовании, направленном на выявление потенциальных мешающих эффектов других лекарств.
Таким образом, представленные данные являются первыми, характеризующими изменения функции нейтрофилов крови больных ПсА до и после терапии секукинумабом. Продемонстрированы тонкие, но сложные изменения в нейтрофилах крови, связанные с заболеванием, по сравнению со здоровыми людьми из контрольной группы, которые включают повышенное количество LDG (у некоторых пациентов) и повышенный хемотаксис по отношению к IL–8. Лечение секукинумабом не повлияло на функции, связанные с защитой организма от инфекций, и не вызвало изменения количества нейтрофилов в крови (в среднем на исходном уровне 4,06·109/мл; в среднем через 48 недель 3,76·109/мл; P = 0,078). Однако при ПсА нейтрофилы имели измененные транскриптомы по сравнению с нейтрофилами здоровых людей из контрольной группы, а лечение секукинумабом вызывало изменения транскриптома нейтрофилов пациентов с ПсА, свидетельствующие о регуляции in vivo посредством измененной передачи сигналов цитокинов.
Выводы
ULTIMATE — это первое рандомизированное плацебо-контролируемое исследование III фазы, которое в первую очередь было направлено на изучение влияния биологических DMARDs на синовит при ПсА, обнаруженный с помощью УЗИ. Исследование продемонстрировало значительный эффект лечения секукинумабом по сравнению с плацебо в уменьшении интенсивности синовита при Пс А. Этот эффект наблюдался уже через 1 неделю после начала лечения и продолжал нарастать при каждом контрольном обследовании до 12-й недели. Ультразвуковое исследование позволило оценить, какие аспекты синовита улучшились в первую очередь.
На сегодняшний день крупные контролируемые исследования для оценки прямого влияния DMARDs на синовит отсутствуют несмотря на наличие объективных инструментов для измерения такого эффекта. Исследование ULTIMATE показало, что активность синовита при ПсА можно оценить на уровне пациента с помощью системы ультразвуковой оценки (GLOESS). Система GLOESS позволила унифицировать оценку активности синовита при исследованиях, которые проводились разными врачами на различных УЗИ аппаратах. Полученные данные позволяют предположить, что оценка синовита с помощью GLOESS является надёжным методом оценки прямого влияния bDMARDs на синовит при ПсА.
Наблюдаемое улучшение признаков и симптомов ПсА при применении секукинумаба подтвердило клиническую эффективность препарата. Лечение секукинумабом хорошо переносилось, а профиль безопасности соответствовал установленному профилю безопасности по утверждённым показаниям16. Поскольку синовит играет решающую роль в разрушении хрящей и костей при ПсА1, 3, 4, можно сделать вывод, что применение секукинумаба способствует защите суставов у пациентов с ПсА.
Список литературы
- Van der Heijde D, Ramiro S, Landewe R et al. 2016 update of the ASAS-EULAR management recommendations for axial spondy — loarthritis. Ann Rheum Dis 2017;76:978–91.
- Jadon DR, Sengupta R, Nightingale A et al. Axial Disease in Psoriatic Arthritis study: defining the clinical and radiographic phenotype of psoriatic spondyloarthritis. Ann Rheum Dis 2017;76:701–7.
- McGonagle D, McDermott MF. A proposed classification of the immunological diseases. PLoS Med 2006;3:e297.
- McGonagle DG, McInnes IB, Kirkham BW, Sherlock J, Moots R. The role of IL–17A in axial spondyloarthritis and psoriatic arthritis: recent advances and controversies. Ann Rheum Dis 2019;78: 1167–78.
- Baeten D, Baraliakos X, Braun J et al. Anti-interleukin-17A mono — clonal antibody secukinumab in treatment of ankylosing spondyli — tis: a randomised, double-blind, placebo-controlled trial. Lancet 2013;382:1705–13.
- McInnes IB, Mease PJ, Kirkham B et al. Secukinumab, a human anti-interleukin-17A monoclonal antibody, in patients with psori — atic arthritis (FUTURE 2): a randomised, double-blind, placebo — controlled, phase 3 trial. Lancet 2015;386:1137–46.
- Mease P, van der Heijde D, Landewe R et al. Secukinumab improves active psoriatic arthritis symptoms and inhibits radio — graphic progression: primary results from the randomised, double — blind, phase III FUTURE 5 study. Ann Rheum Dis 2018;77:890–7.
- Mease PJ, Kavanaugh A, Reimold A et al. Secukinumab in the treatment of psoriatic arthritis: efficacy and safety results through 3 years from the year 1 extension of the randomised phase III FUTURE 1 trial. RMD Open 2018;4:e000723.
- Coates LC, Mease PJ, Gossec L et al. Minimal disease activity among active psoriatic arthritis patients treated with secukinumab: 2-year results from a multicenter, randomized, double-blind, paral — lel-group, placebo-controlled phase III study. Arthritis Care Res (Hoboken) 2018;70:1529–35.
- Coates LC, Wallman JK, McGonagle D et al. Secukinumab efficacy on resolution of enthesitis in psoriatic arthritis: pooled analysis of two phase 3 studies. Arthritis Res Ther 2019;21:266.
- Nash P, Mease PJ, McInnes IB et al. Efficacy and safety of secukinu — mab administration by autoinjector in patients with psoriatic ar — thritis: results from a randomized, placebo-controlled trial (FUTURE 3). Arthritis Res Ther 2018;20:47.
- van der Heijde D, Mease PJ, Landewe RBM et al. Secukinumab provides sustained low rates of radiographic progression in psori — atic arthritis: 52-week results from a phase 3 study, FUTURE 5. Rheumatology (Oxford) 2020;59:1325–34.
- Cantini F, Nannini C, Niccoli L et al. Risk of tuberculosis reactiva — tion in patients with rheumatoid arthritis, ankylosing spondylitis, and psoriatic arthritis receiving non-anti-TNF-targeted biologics. Mediators Inflamm 2017;2017:8909834.
- Garziera G, Morsch ALB, Otesbelgue F et al. Latent tuberculosis infection and tuberculosis in patients with rheumatic diseases treated with anti-tumor necrosis factor agents. Clin Rheumatol 2017;36:1891–6.
- Deodhar A, Mease PJ, McInnes IB et al. Long-term safety of secuki — numab in patients with moderate-to-severe plaque psoriasis, psori — atic arthritis, and ankylosing spondylitis: integrated pooled clinical trial and post-marketing surveillance data. Arthritis Res Ther 2019;21:111.
- Su R, Peng YP, Deng Z et al. Mycobacterium tuberculosis infection induces low-density granulocyte generation by promoting neutro — phil extracellular trap formation via ROS pathway. Front Microbiol 2019;10:1468.
- Edwards SW, Spofford EM, Price C et al. Opisthorchiasis-induced cholangiocarcinoma: how innate immunity may cause cancer. Adv Parasitol 2018;101:149–76.
- Wright HL, Moots RJ, Bucknall RC, Edwards SW. Neutrophil function in inflammation and inflammatory diseases. Rheumatology (Oxford) 2010;49:1618–31.
- Glennon-Alty L, Hackett AP, Chapman EA, Wright HL. Neutrophils and redox stress in the pathogenesis of autoimmune disease. Free Radic Biol Med 2018;125:25–35.
- Thieblemont N, Wright HL, Edwards SW, Witko-Sarsat V. Human neutrophils in autoimmunity. Semin Immunol 2016;28: 159–73.
- Muller-Ladner U, Gay RE, Gay S. Role of nuclear factor jB in synovial inflammation. Curr Rheumatol Rep 2002;4:201–7.
- Yamamoto Y, Gaynor RB. Role of the NF-jB pathway in the path — ogenesis of human disease states. Curr Mol Med 2001;1:287–96.
- Wright HL, Chikura B, Bucknall RC, Moots RJ, Edwards SW. Changes in expression of membrane TNF, NF-jB activation and neutrophil apoptosis during active and resolved inflammation. Ann Rheum Dis 2011;70:537–43.
- Tokura Y, Mori T, Hino R. Psoriasis and other Th17-mediated skin diseases. J UOEH 2010;32:317–28.
- Bertelsen T, Ljungberg C, Litman T et al. IjBf is a key player in the antipsoriatic effects of secukinumab. J Allergy Clin Immunol 2020; 145:379–90.
- Katayama H. Development of psoriasis by continuous neutrophil infiltration into the epidermis. Exp Dermatol 2018;27:1084–91.
- Chen D, Jiang R, Mao C et al. Chemokine/chemokine receptor interactions contribute to the accumulation of Th17 cells in patients with esophageal squamous cell carcinoma. Hum Immunol 2012;73:1068–72.
- Pelletier M, Maggi L, Micheletti A et al. Evidence for a cross-talk between human neutrophils and Th17 cells. Blood 2010;115: 335–43.
- Clegg DO, Reda DJ, Weisman MH et al. Comparison of sulfasala#zine and placebo in the treatment of reactive arthritis (Reiter’s syn#drome). A Department of Veterans Affairs Cooperative Study. Arthritis Rheum 1996;39:2021–7.
- Thomas HB, Moots RJ, Edwards SW, Wright HL. Whose gene is it anyway? The effect of preparation purity on neutrophil transcrip#tome studies. PLoS One 2015;10:e0138982.
- Wright HL, Makki FA, Moots RJ, Edwards SW. Low-density gran — ulocytes: functionally distinct, immature neutrophils in rheumatoid arthritis with altered properties and defective TNF signalling. J Leukoc Biol 2017;101:599–611.
- Fossati G, Moulding DA, Spiller DG et al. The mitochondrial net — work of human neutrophils: role in chemotaxis, phagocytosis, re — spiratory burst activation, and commitment to apoptosis. J Immunol 2003;170:1964–72.
- Wright HL, Cox T, Moots RJ, Edwards SW. Neutrophil biomarkers predict response to therapy with tumor necrosis factor inhibitors in rheumatoid arthritis. J Leukoc Biol 2017;101: 785–95.
- Krueger JG, Fretzin S, Suarez-Farinas M et al. IL–17A is essential for cell activation and inflammatory gene circuits in subjects with psoriasis. J Allergy Clin Immunol 2012;130:145–54 e9.
- Tamassia N, Arruda-Silva F, Calzetti F et al. A reappraisal on the potential ability of human neutrophils to express and produce IL–17 family members in vitro: failure to reproducibly detect it. Front Immunol 2018;9:795.
- Tamarozzi F, Wright HL, Thomas HB, Edwards SW, Taylor MJ. A lack of confirmation with alternative assays questions the validity of IL–17A expression in human neutrophils using immunohisto — chemistry. Immunol Lett 2014;162(2 Pt B):194–8.
- de Jesus-Gil C, Ruiz-Romeu E, Ferran M et al. IL–15 and IL–23 syn — ergize to trigger Th17 response by CLAþ T cells in psoriasis. Exp Dermatol 2020;29:630–8.
11252081/SEC/DIG/08.24/0