Введение
Псориатический артрит (ПсА) характеризуется воспалением синовиальной оболочки суставов и энтезисов, что сопровождается болью, структурными изменениями, нарушением функции суставов и ухудшением качества жизни пациентов1-5. Основной целью лечения ПсА, как и любой другой формы артрита, является устранение воспаления в суставах. Однако, на сегодняшний день, влияние лекарственной терапии на заболевание обычно измеряется косвенно, путём оценки выраженности симптоматики, а не напрямую, путём оценки воспаления в тканях суставов. Следовательно, мало что известно о динамическом влиянии болезнь-модифицирующих антиревматических препаратов (DMARDs) на синовит.
Ультразвук в В‑режиме в сочетании с энергетической допплерографией (Power doppler ultra sound, PDUS) позволяет визуализировать как морфологические, так и функциональные изменения синовиальной оболочки6,7. EULAR и OMERACT недавно стандартизировали использование PDUS для выявления синовита и разработали комплексную систему оценки воспаления в тканях суставов the Global EULAR-OMERACT Synovitis Score (GLOESS), которая показала высокую чувствительность и превосходную надёжность у пациентов с ревматоидным артритом8-11, что указывает на возможность её использования для мониторинга ответа на терапию воспалительных артритов.
Препарат секукинумаб, человеческое моноклональное антитело, которое непосредственно ингибирует IL–17A, продемонстрировал устойчивую эффективность в отношении признаков и симптомов, ингибирование прогрессирования структурных повреждений и благоприятный долгосрочный профиль безопасности у пациентов с ПсА в течение 5 лет12-14. Однако, мало что известно о его прямом влиянии на синовит и энтезит и о динамике ответа на терапию. Клиническое испытание ULTIMATE является первым рандомизированным, плацебо-контролируемым исследованием на основе PDUS при ПсА, которое в первую очередь фокусируется на ответе со стороны синовита, а не на симптомах заболевания15.
Целью клинического испытания ULTIMATE стала демонстрация возможностей секукинумаба для подавления синовита по оценке методом PDUS у пациентов с ПсА, которые имели недостаточный ответ на терапию обычными синтетическими противоревматическими препаратами (csDMARDs) и не получали ранее биологической терапии (bDMARDs)15. Ниже будут представлены первые результаты эффективности применения секукинумаба при синовите у пациентов с активным ПсА.
Методы
Пациенты и дизайн исследования
Ключевые критерии для включения в исследование:
- Взрослые пациенты ≥18 лет;
- ПсА в течение ≥6 месяцев, соответствие критериям CASPAR;
- Возможно продолжение терапии метотрексатом, глюкокортикоидами и НПВП в стабильной стандартной дозе в период от 1 мес до 24 недель до скрининга;
- Неадекватный ответ на синтетические DMARDs;
- ≥3 из 78 болезненных суставов и ≥3 из 76 отёчных суставов;
- Наличие активного синовита по данным PDUS, а также по крайней мере одного клинического энтезита.
Ключевые критерии исключения из исследования:
- Предшествующая терапия биологическими DMARDs, включая ингибиторы фактора некроза опухоли;
- Предшествующая терапия секукинумабом или другими биологическими препаратами класса ингибиторов IL–17 или рецептора к IL–17;
- Наличие иммуновоспалительного заболевания в активной фазе, кроме ПсА;
- Наличие инфекционного заболевания в активной фазе в течение 2 недель до рандомизации, наличие ВИЧ, гепатита B или C при рандомизации;
- Признаки злокачественного процесса в активной фазе, онкопатологии в анамнезе в течение последних 5 лет.
ULTIMATE (NCT02662985) это многоцентровое рандомизированное двойное слепое плацебо-контролируемое исследование III фазы продолжительностью 52 недели, которое проходило в 37 центрах в 17 странах начиная с 22 августа 2016 г. Это исследование состояло из фазы скрининга продолжительностью от 1 до 4 недель, за которой следовал 12-недельный период двойного слепого плацебо-контролируемого лечения (TP 1; от начала до 12 недели); 12-недельный открытый период (TP 2; с 12 по 24 неделю); 6-месячный открытый период продления (TP 3; с 24 по 52 неделю); и 12-недельный период наблюдения за безопасностью (с 52 по 64 неделю)15.
Пациенты, включённые в исследование, были рандомизированы (1:1) с использованием технологии интерактивного ответа (IRT) для получения либо секукинумаба подкожно (300 мг или 150 мг), либо плацебо еженедельно с последующим 4-недельным дозированием на 4 и 8 неделе в двойном слепом режиме (дополнительное исследование). Пациенты получали секукинумаб в дозе 300 или 150 мг в зависимости от тяжести кожных проявлений. Открытая фаза началась на 12 неделе (TP 2), и все пациенты (включая группу плацебо) получали секукинумаб в дозе 300 мг или 150 мг в зависимости от тяжести кожных проявлений15.
Оценка суставов с помощью УЗИ
Оценка PDUS проводилась на старте исследования и спустя 1, 2, 4, 6, 8 и 12 недель. Оценивались следующие 24 сустава: пястно-фаланговые 1–5, проксимальные межфаланговые 1–5, плюснефаланговые 1–5, дистальные межфаланговые 2–5, запястья, локти, плечи, колени и голеностопные суставы (большеберцово-таранный). Суставы сканировались при каждом посещении с дорсальной стороны, при этом сустав находился в нейтральном положении, за исключением колена, которое исследовалось в положении сгибания под углом 30º. Сканировались все углубления каждого сустава, степень поражения сустава определялась по максимальной степени синовита PDUS в одном из углублений15.
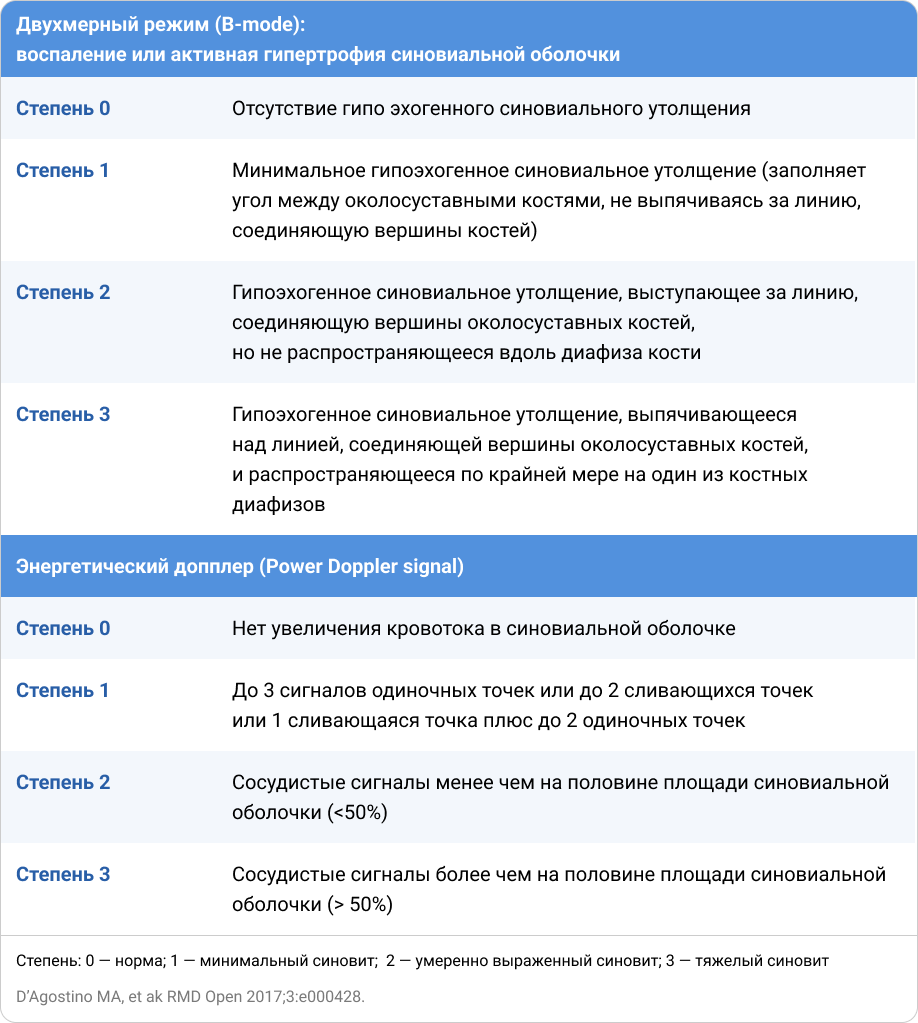
Синовит PDUS определялся в соответствии с EULAR-OMERACT как гипоэхогенная гипертрофия синовии (SH), обнаруженная в B-режиме. При каждом посещении синовит PDUS оценивался полуколичественно (0–3) в соответствии с комплексной шкалой EULAR-OMERACT PDUS8, 11.
Приложение 1. Шкала ультразвуковой оценки для компонентов двухмерного режима (B-mode) и энергетического допплера (PD) в соответствии с EULAR-OMERACT
Клинические оценки и оценки безопасности
Проводилась клиническая оценка болезненности и припухлости суставов для расчёта числа болезненных суставов (TJC) и числа отёчных суставов (SJC). Кроме того, оценивались показатели улучшения ACR 20, 50 и 70 и их основные компоненты, а также среднее изменение индекса инвалидности HAQ (HAQ-DI) по сравнению с исходным уровнем. Оценки безопасности, включая нежелательные явления (НЯ), серьёзные НЯ и НЯ, представляющие особый интерес, возникшие в течение первых 12 недель, проводились у всех пациентов, получивших хотя бы одну дозу исследуемого препарата15.
Полученные результаты
Всего было обследовано 258 пациентов, из которых 82 не подходили для участия в исследовании, а 10 не были включены по другим причинам. Из 166 пациентов (64%), включённых в исследование, 161 (97%) завершили первые 12 недель (секукинумаб, 99%; плацебо, 95%; рис. 1). Доля пациентов с хотя бы одним отклонением от протокола составила 15% (секукинумаб — 16%; плацебо — 13%). Демографические и исходные клинические характеристики в обеих группах пациентов были сопоставимы. Средний возраст пациентов составил 47 лет, медиана продолжительности заболевания — 4 года, 55% — женщины. Исходно у пациентов было активное заболевание, число болезненных суставов в среднем составило 14, среднее число отёчных суставов — 9, средний показатель площади и индекса тяжести кожного псориаза — 1015.
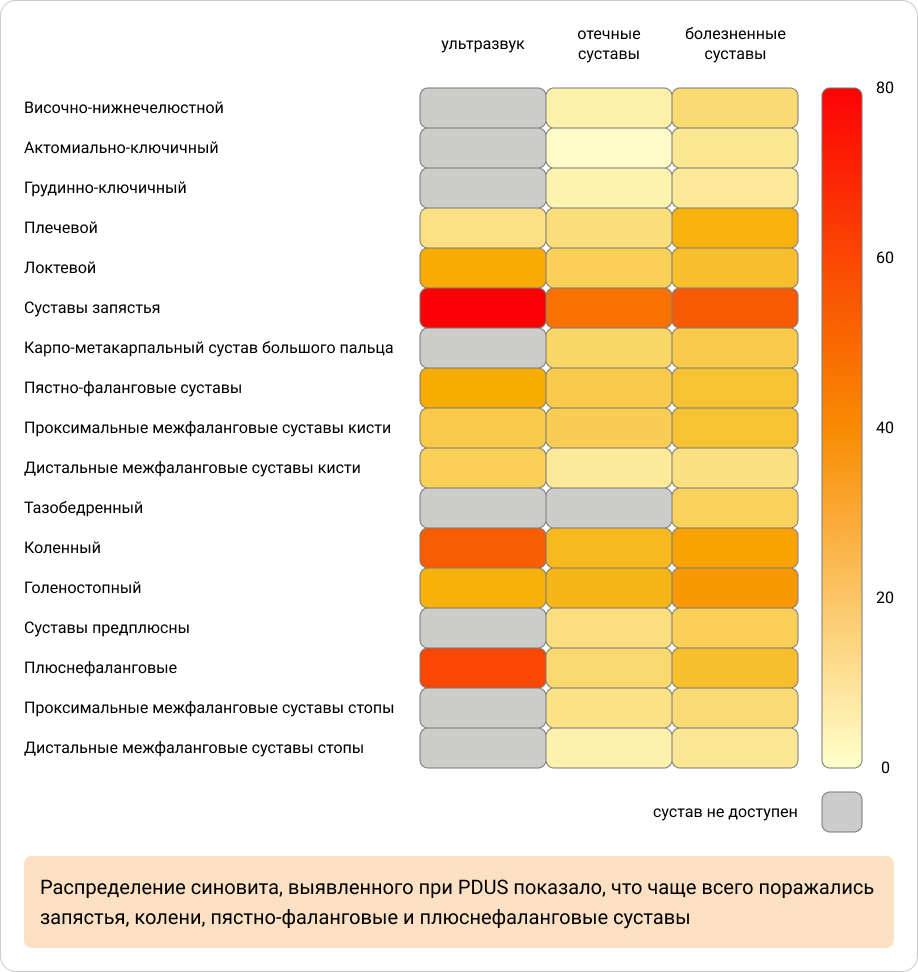
Распределение синовита PDUS показало, что суставы запястья, колена, пястно-фаланговые и плюснефаланговые поражались чаще8.
Приложение 2. Исходное распределение синовита, выявленного при УЗИ в контексте с исходным распределением болезненных (TJC) и отечных (SJC) суставов
Эффективность при оценке методом PDUS
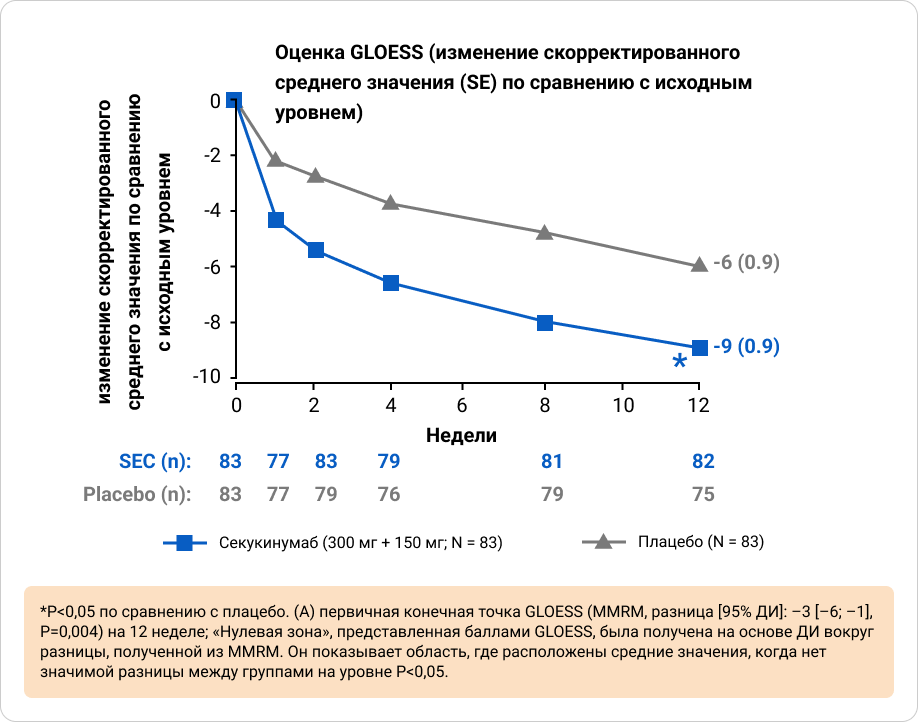
Первичная конечная точка была достигнута на 12-й неделе; изменение скорректированного среднего значения (SE) GLOESS по сравнению с исходным уровнем было значительно выше в группе секукинумаба по сравнению с плацебо8.
Приложение 3. Первичная конечная точка: различие в оценке по шкале GLOESS от исходного уровня до недели 12 между группой секукинумаба и плацебо
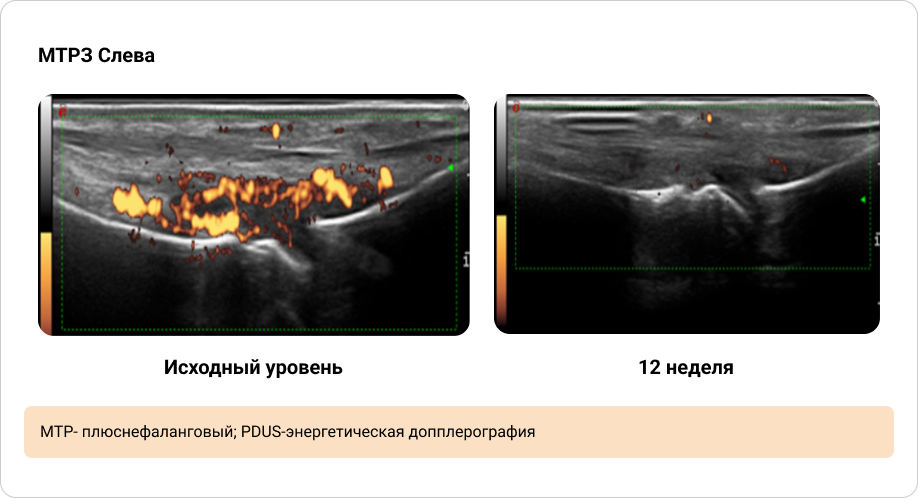
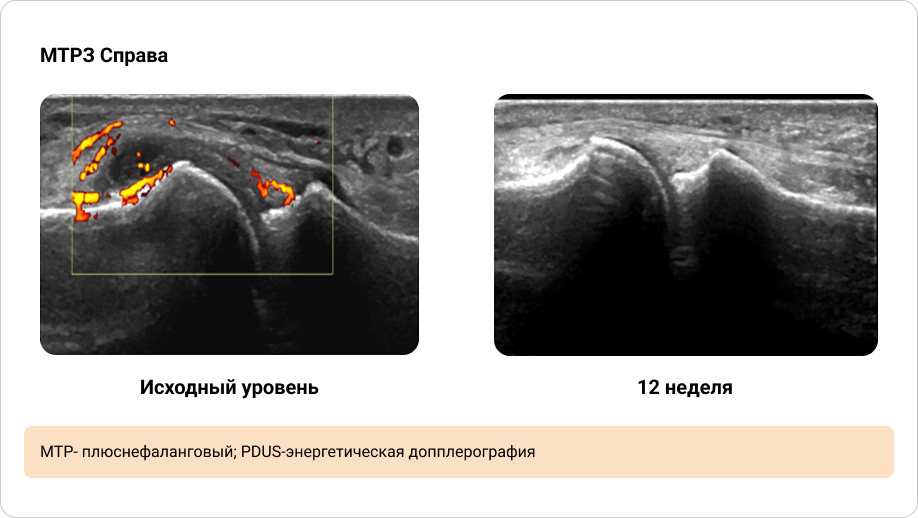
Приложение 4. Иллюстрация динамики синовита, выявленного при PDUS исходно и через 12 недель терапии (1/2)
Приложение 5. Иллюстрация динамики синовита, выявленного при PDUS исходно и через 12 недель терапии (2/2)
Клиническая эффективность
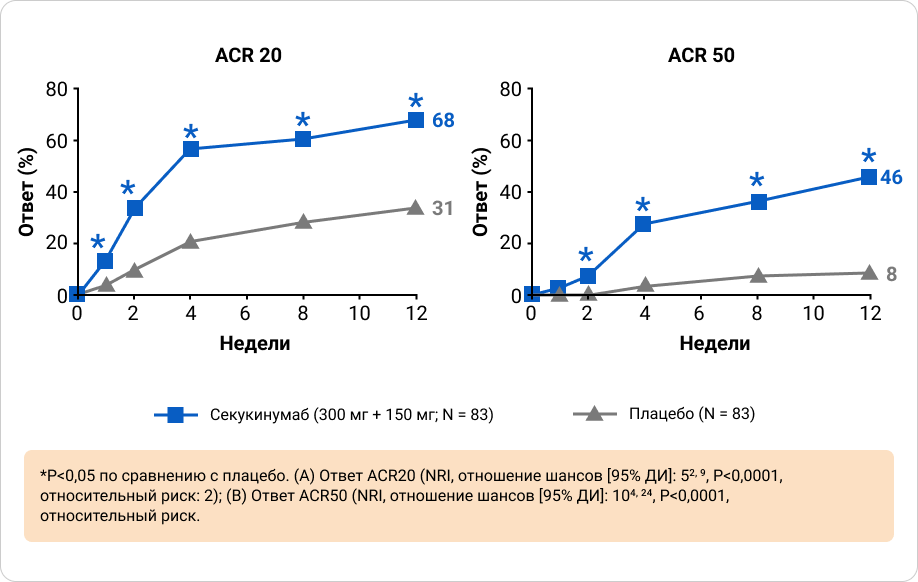
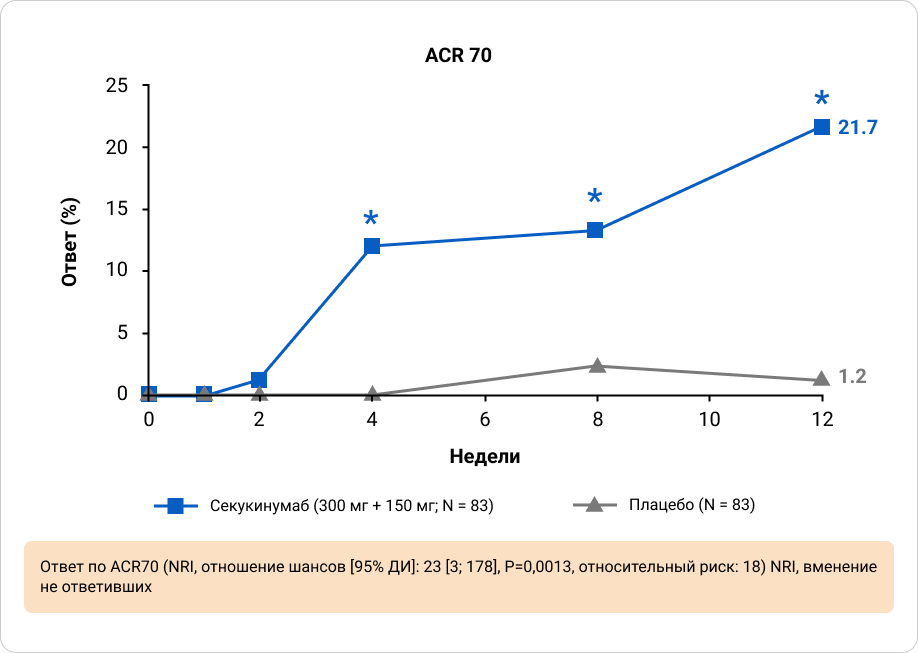
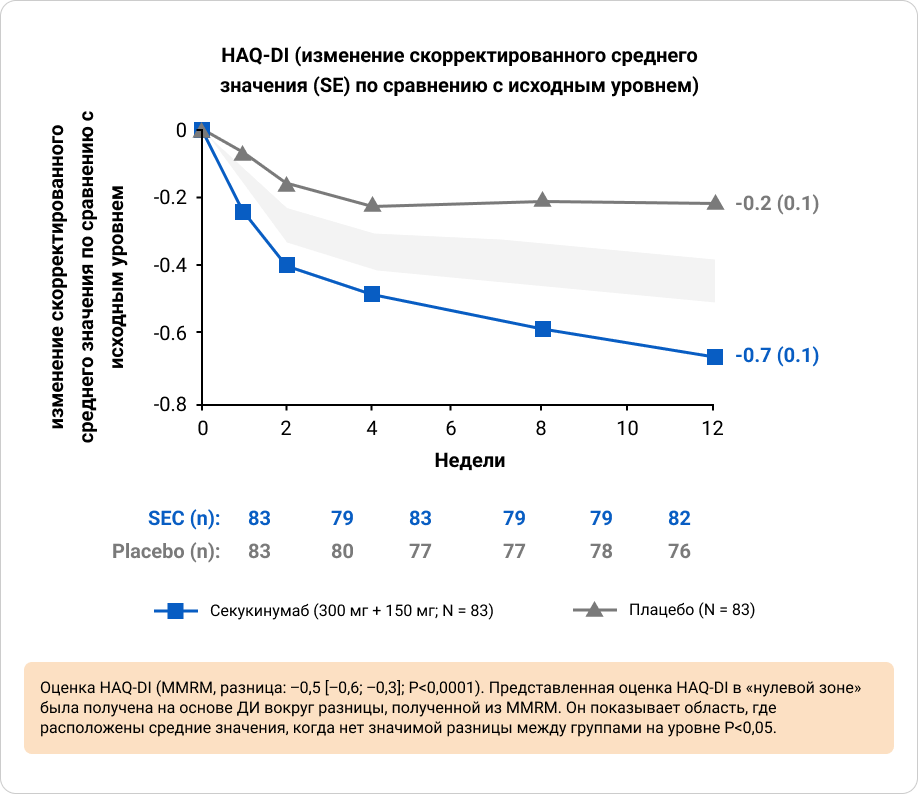
Ответы ACR20 и ACR50 на 12 неделе были выше у пациентов, получавших секукинумаб, по сравнению с плацебо, при этом значительные улучшения наблюдались уже на 1 неделе для ACR20 и на 2 неделе для ACR50 по сравнению с плацебо. Значительно более высокие ответы наблюдались у пациентов, получавших секукинумаб, по исследовательским конечным точкам (ответ ACR70 и показатель HAQ-DI) на 12 неделе по сравнению с плацебо8.
Приложение 6. Ключевая вторичная конечная точка: ответы по ACR 20 и 50 через 12 недель
Приложение 7. Ответ по ACR 70 через 12 недель
Приложение 8. Динамики опросника оценки здоровья с индексом инвалидности (HAQ-DI) от исходного до недели12
Безопасность
В целом частота НЯ, возникших во время лечения, до 12-й недели составила 58% в группе секукинумаба и 57% в группе плацебо. Самыми частыми НЯ были назофарингит, гипертония, диарея, головная боль и латентный туберкулёз как в группе секукинумаба, так и в группе плацебо. В группе секукинумаба не было зарегистрировано серьёзных НЯ. Ни в одной из групп лечения не было зарегистрировано ни одного случая смерти, серьёзных инфекций, нейтропении, серьёзных неблагоприятных сердечно-сосудистых событий, воспалительных заболеваний кишечника или злокачественных новообразований8.
Приложение 9. Оценка безопасности терапии на протяжении 12 недель
Выводы
ULTIMATE — это первое рандомизированное плацебо-контролируемое исследование III фазы, которое в первую очередь было направлено на изучение влияния биологических DMARDs на синовит при ПсА, обнаруженный с помощью УЗИ. Исследование продемонстрировало значительный эффект лечения секукинумабом по сравнению с плацебо в уменьшении интенсивности синовита при Пс А. Этот эффект наблюдался уже через 1 неделю после начала лечения и продолжал нарастать при каждом контрольном обследовании до 12-й недели. Ультразвуковое исследование позволило оценить, какие аспекты синовита улучшились в первую очередь.
На сегодняшний день крупные контролируемые исследования для оценки прямого влияния DMARDs на синовит отсутствуют несмотря на наличие объективных инструментов для измерения такого эффекта. Исследование ULTIMATE показало, что активность синовита при ПсА можно оценить на уровне пациента с помощью системы ультразвуковой оценки (GLOESS). Система GLOESS позволила унифицировать оценку активности синовита при исследованиях, которые проводились разными врачами на различных УЗИ аппаратах. Полученные данные позволяют предположить, что оценка синовита с помощью GLOESS является надёжным методом оценки прямого влияния bDMARDs на синовит при Пс А.
Наблюдаемое улучшение признаков и симптомов ПсА при применении секукинумаба подтвердило клиническую эффективность препарата. Лечение секукинумабом хорошо переносилось, а профиль безопасности соответствовал установленному профилю безопасности по утверждённым показаниям16. Поскольку синовит играет решающую роль в разрушении хрящей и костей при ПсА1, 3, 4, можно сделать вывод, что применение секукинумаба способствует защите суставов у пациентов с ПсА.
Список литературы
- Day MS, Nam D, Goodman S, Su EP, Figgie M. Psoriatic arthritis. J Am Acad Orthop Surg 2012;20:28–37.
- Gladman DD, Antoni C, Mease P, Clegg DO, Nash P. Psoriatic arthritis: epidemiology, clinical features,course, and outcome. Ann Rheum Dis 2005;64(Suppl2):ii14–7.
- Ritchlin CT, Colbert RA, Gladman DD. Psoriatic arthritis. N Engl J Med 2017;376:957–70.
- Veale DJ, Fearon U. The pathogenesis of psoriatic arthritis. Lancet 2018;391:2273–84.
- Coates LC, Kavanaugh A, Ritchlin CT; GRAPPA Treatment Guideline Committee. Systematic review of treatments for psoriatic arthritis: 2014 update for the GRAPPA. J Rheumatol 2014;41:2273–6.
- Uson J, Loza E, Mo¨ ller I et al. Recommendations for the use of ultrasound and magnetic resonance in patients with spondyloarthritis, including psoriatic arthritis, and patients with juvenile idiopathic arthritis. Reumatol Clin 2018;14:27–35.
- D’Agostino MA, Aegerter P, Bechara K et al. How to diagnose spondyloarthritis early? Accuracy of peripheral enthesitis detection by power Doppler ultrasonography. Ann Rheum Dis 2011;70:1433–40.
- D’Agostino MA, Terslev L, Aegerter P et al. Scoring ultrasound synovitis in rheumatoid arthritis: a EULAR-OMERACT ultrasound taskforce-Part 1: definition and development of a standardised, consensus-based scoring system. RMD Open 2017;3:e000428.
- Mandl P, Navarro-Compa´ n V, Terslev L et al. EULAR recommendations for the use of imaging in the diagnosis and management of spondyloarthritis in clinical practice. Ann Rheum Dis 2015;74:1327–39.
- Terslev L, Naredo E, Aegerter P et al. Scoring ultrasound synovitis in rheumatoid arthritis: a EULAR-OMERACT ultrasound taskforce-Part 2: reliability and application to multiple joints of a standardised consensus-based scoring system. RMD Open 2017;3:e000427.
- Wakefield RJ, D’Agostino MA, Iagnocco A et al. The OMERACT Ultrasound Group: status of current activities and research directions. J Rheumatol 2007;34:848–51.
- Mease PJ, Kavanaugh A, Reimold A et al. Secukinumab in the treatment of psoriatic arthritis: efficacy and safety results through 3 years from the year 1 extension of the randomised phase III FUTURE 1 trial. RMD Open 2018;4:e000723.
- McInnes IB, Mease PJ, Kivitz AJ et al. Long-term efficacy and safety of secukinumab in patients with psoriatic arthritis: 5-year (end-of-study) results from the phase 3 FUTURE 2 study. Lancet Rheumatol 2020;2:e227–35.
- van der Heijde D, Mease PJ, Landewe RBM et al. Secukinumab provides sustained low rates of
- radiographic progression in psoriatic arthritis: 52-week results from a phase 3 study, FUTURE 5. Rheumatology 2020;59:1325–34.
- D’Agostino, Maria Antonietta, et al. Response to Secukinumab on Synovitis Using Power Doppler Ultrasound in Psoriatic Arthritis : 12-Week Results from a Phase III Study, ULTIMATE. Rheumatology, vol. 61, no. 5, 2022, pp. 1867–76, doi:10.1093/rheumatology/keab628.
- Deodhar A, Mease PJ, McInnes IB et al. Long-term safety of secukinumab in patients with moderate-to-severe plaque psoriasis, psoriatic arthritis, and ankylosing spondylitis: integrated pooled clinical trial and post-marketing surveillance data. Arthritis Res Ther 2019;21:111.
786842/GenMed/DIG/03.24/0