По материалам публикации Queiro R, Aurrecoechea E, Alonso Castro S, Villa Blanco I, Brandy-Garcia A, Linge R. Interleukin-17-targeted treatment in patients with spondyloarthritis and associated cardiometabolic risk profile. Front Immunol. 2023 Jul 18;14:1203372. doi: 10.3389/fimmu.2023.1203372. PMID: 37533855; PMCID: PMC10391638. https://www.frontiersin.org/journals/immunology/articles/10.3389/fimmu.2023.1203372/full
Спондилоартрит (СпА) — это группа иммуноопосредованных ревматических заболеваний, включающая аксиальный спондилоартрит (аксСпА), псориатический артрит (ПсА), реактивный артрит, энтеропатический артрит и недифференцированный спондилоартрит1.
Эти патологии взаимосвязаны и имеют общие клинические черты, а также общую генетическую связь с главным комплексом гистосовместимости I типа HLA-B272. Типичные клинические характеристики включают воспаление крестцово-подвздошных суставов, позвоночника и энтезов, вне мышечно-скелетные проявления (например, псориаз, увеит и воспалительные заболевания кишечника) и образование новых костных структур в крестцово-подвздошных суставах и позвоночнике3, 4. Аксиальный СпА характеризуется наличием воспаления осевого скелета и может быть далее разделен на анкилозирующий спондилит (АС, также известный как рентгенографический аксСпА, поскольку на рентгенограммах видны структурные повреждения позвоночника и крестцово-подвздошных суставов) и нерентгенографический аксСпА (структурный спондилит, при котором повреждения не видны на рентгенограммах)2, 3. ПсА характеризуется аксиальными и периферическими скелетно-мышечными проявлениями, которые сопровождаются заболеваниями кожи и ногтей4, 5. ПсА и аксСпА, а также другие формы СпА связаны с хронической болью и скованностью и оказывают значительное влияние на функциональность и качество жизни (КЖ) пациентов2–5.
Целями лечения СпА являются достижение ремиссии заболевания (контроль активности заболевания и предотвращение рентгенологической прогрессии), поддержание функциональности пораженных суставов и улучшение качества жизни6, 7.
Лечением первой линии для пациентов с аксСпА и ПсА являются нестероидные противовоспалительные препараты (НПВП), в сочетании с физиотерапией и физическими упражнениями5, 7, 8. Обычные болезнь-модифицирующие антиревматические препараты (DMARD), такие как метотрексат, сульфасалазин или лефлуномид, как правило, неэффективны при лечении аксСпА8, хотя, согласно данным наблюдений, они часто используются при периферических проявлениях9.
Биологическая терапия, направленная на два основных воспалительных пути, участвующих в развитии аксСпА и ПсА: фактор некроза опухоли альфа (ФНО-α) и оси интерлейкина (IL)-23/IL–17, является наиболее распространенным выбором для пациентов со СпА, у которых заболевание остается активным, несмотря на лечение обычными DMARD5, 7, 8, 10. Ингибиторы ФНО-α инфликсимаб, этанерцепт, адалимумаб, голимумаб и цертолизумаб, а также ингибиторы IL–17 секукинумаб и иксекизумаб обычно используются для лечения аксСпА и Пс А. Новая молекула бимекизумаб, которая одновременно нацелена на IL–17A и IL–17F, также показала положительные результаты при лечении аксСпА и ПсА и в настоящее время находится в разработке11. Ингибитор IL–12/23 p40 устекинумаб и ингибиторы IL–23 p19 гуселькумаб и рисанкизумаб являются эффективными средствами лечения ПсА, а другой ингибитор IL–23 p19, тилдракизумаб, исследуется на предмет его терапевтического потенциала при Пс А. Однако блокада IL–12/23 и IL–23 не показала эффективности у пациентов с аксСпА12, 13. Другие таргетные препараты включают ингибитор фосфодиэстеразы-4 (ФДЭ4) апремиласт, а также ингибиторы янус-киназы/преобразователи сигнала и активаторы ингибиторов транскрипции (JAK/STAT, например, филготиниб, тофацитиниб, упадацитиниб и деукравацитиниб)8. Некоторые из этих препаратов проходят клинические испытания при СпА, а некоторые одобрены и уже включены в руководства, но еще не внедрены в клиническую практику7, 8, 10.
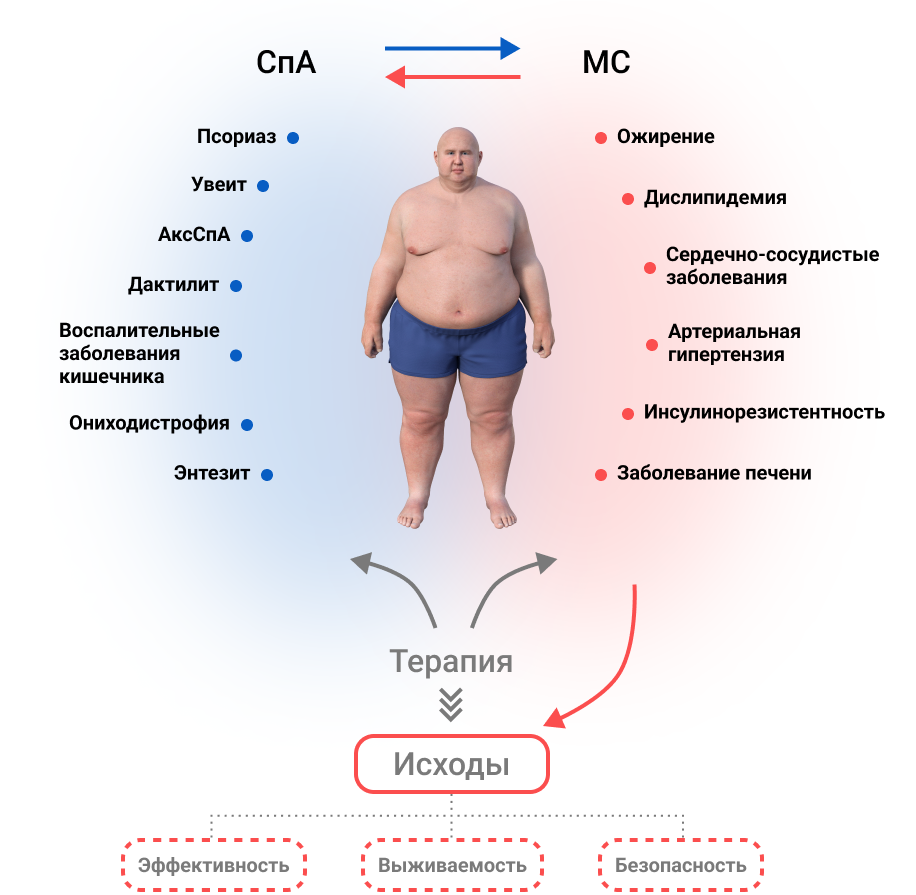
АксСпА и ПсА часто связаны с рядом сопутствующих кардиометаболических заболеваний, включая ожирение, гипертонию, дислипидемию и сахарный диабет, известные под общим названием метаболический синдром (МС), и, следовательно, с повышенным риском сердечно-сосудистой заболеваемости и смертности14–16. Терапевтические решения у пациентов со СпА традиционно основывались на данных рандомизированных контролируемых исследований, подтвержденных реальными исследованиями, а также на профиле пользы и риска каждого вмешательства; однако при принятии решения о лечении важно учитывать сопутствующие кардиометаболические заболевания, имеющие высокую распространенность17. Клинические рекомендации по аксСпА и ПсА предписывают учитывать сопутствующие патологии наряду с активным заболеванием при выборе оптимального лечения18–20 , рекомендации Европейского альянса ассоциаций ревматологов (EULAR) по управлению риском сердечно-сосудистых заболеваний (ССЗ) указывают на необходимость раннего скрининга факторов риска сердечно-сосудистых заболеваний и МС для всех пациентов с воспалительными заболеваниями суставов21.
В 2022 году мы провели обзор статей, посвященных лечению СпА у пациентов с сопутствуюшими кардиометаболическими патологиями и обобщили доказательства физиологической связи между воспалительным статусом и кардиометаболическими сопутствующими заболеваниями при СпА, а также влияние блокады IL–17 по сравнению с другими молекулярными механизмами у пациентов с кардиометаболическими заболеваниями. В обзор были включены преимущественно публикации за последние 5 лет, хотя рассматривались и более старые статьи, если они имели отношение к теме.
Кардиометаболический профиль больных спондилоартритом
Распространенность сопутствующих кардиометаболических заболеваний
Среди пациентов с аксСпА и ПсА высока распространенность кардиометаболических нарушений15, 22–26 ; они характерны для аксСпА и ПсА и отличаются от тех, которые обнаруживаются при других аутоиммунных заболеваниях25. Оценка факторов сердечно-сосудистого риска у 692 пациентов с ПсА показала, что у них достоверно выше распространенность ожирения, артериальной гипертензии и диабета по сравнению с контрольной группой27. По данным другого обследования 2896 пациентов с ПсА, АС или РА, ожирение было более распространено среди пациентов с ПсА, чем у пациентов с АС или РА28. Аналогичные результаты были получены в двух ретроспективных перекрестных исследованиях Кейро и его коллег29, 30.
Оценка сопутствующих заболеваний среди 202 китайских пациентов со СпА показала, что у 3,0% был диабет, у 20,3% - гипертония и у 30,8% - гиперлипидемия31. Анализ большой группы пациентов из Северной Америки показал, что у пациентов с ПсА вероятность развития МС значительно выше, чем у пациентов с РА32. В средиземноморской популяции распространенность МС была значительно выше среди пациентов с ПсА, чем в контрольной группе33.
Систематический обзор и метаанализ, оценивающий распространенность МС в популяциях ПсА, псориаза и РА, показали, что пациенты с ПсА чаще страдают МС, чем пациенты с псориазом34. Другой метаанализ показал, что тремя наиболее распространенными сопутствующими заболеваниями у пациентов с аксСпА были гипертония, гиперлипидемия и ожирение35.
Неоднородность сопутствующих заболеваний у пациентов с аксСпА и ПсА может быть обусловлена географическими факторами и особенностями образа жизни36–38. В частности, можно сделать вывод, что в странах, питание которых основано на так называемой «средиземноморской диете» (Италия, Греция, Испания), показатели кардиометаболических факторов риска отличаются от других стран39. Также существуют различия между полами в отношении сопутствующих заболеваний у пациентов с аксСпА40.
Влияние сопутствующих кардиометаболических патологий на активность заболевания
Наличие кардиометаболических нарушений связано с активностью заболеваний ПсА и аксСпА, а также с неспособностью достичь статуса минимальной активности заболевания (MDA)25. В частности, ожирение связано с воспалением, активностью заболевания и факторами риска сердечно-сосудистых заболеваний41–45. Систематический обзор литературы, оценивающий радиологические результаты у пациентов со СпА, показал, что ожирение связано с энтезальным воспалением и образованием как осевой, так и периферической новой кости46. У пациентов с ожирением и АС были зарегистрированы значительно более высокие уровни С-реактивного белка (СРБ), активности заболевания (по оценке ASDAS-CRP), более значительные рентгенологические изменения, уровни влияния на физическую подвижность, функцию печени и артериальное давление44.
На сегодняшний день два исследования продемонстрировали корреляцию между снижением массы тела и достижением MDA у пациентов с избыточным весом и ожирением с ПсА47, 48. В одном исследовании пациенты с ПсА с ожирением, получавшие терапию ингибитором ФНО, имели значительно большую вероятность достижения MDA при соблюдении гипокалорийной диеты по сравнению со свободной диетой47. Во втором исследовании у пациентов с ПсА, страдающих ожирением, которые прошли курс снижения веса с помощью жидкой диеты с очень низким содержанием энергии в течение 12–16 недель, продемонстрировали значительное снижение активности заболевания через 6 месяцев наблюдения48 , которое сохранялось в течение 2 лет с одновременным улучшением сердечно-сосудистых факторов риска49.
Пути воспаления, общие для кардиометаболических нарушений и спондилоартрита: роль интерлейкина-17
Высокая распространенность кардиометаболических нарушений среди пациентов с ПсА и аксСпА и их связь с активностью заболевания позволяют предположить существование общих сигнальных путей и взаимозависимых воспалительных механизмов. Действительно, иммунная система и обмен веществ связаны через адипокины и цитокины22, 23, 50.
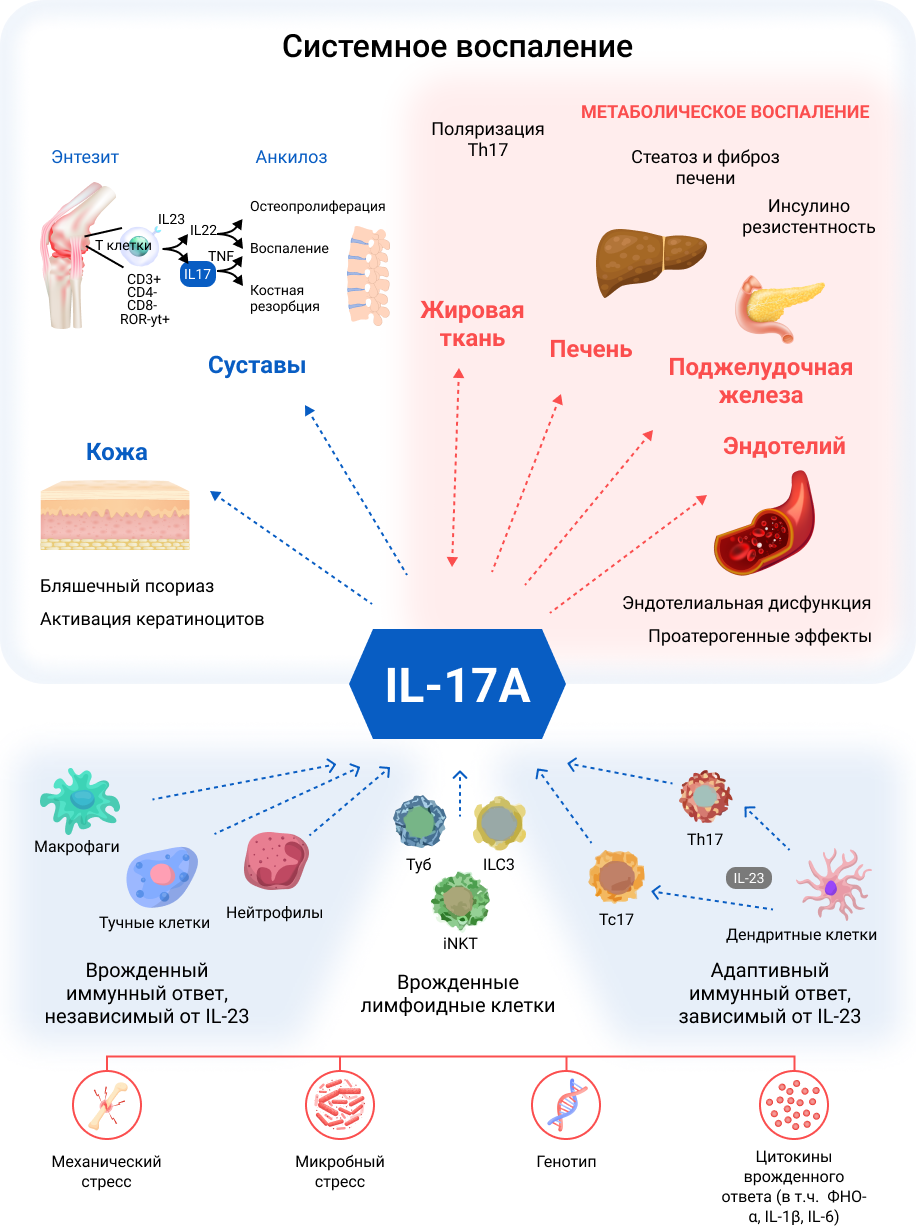
Семейство IL–17 состоит из шести провоспалительных цитокинов (от A до F), из которых IL–17A является наиболее изученным и наиболее важным членом51–53. IL–17A действует на несколько клеточных мишеней, включая кератиноциты, нейтрофилы, эндотелиальные клетки, остеокласты, хондроциты и остеобласты, стимулирует выработку антимикробных пептидов, хемокинов и провоспалительных цитокинов51, 53–55, 56. В физиологических условиях IL–17A способствует восстановлению слизистых оболочек и поддерживает противоинфекционный иммунный ответ (рисунок 1)51, 55, 57.
Рисунок 1. Ключевая роль интерлейкина (IL)-17A в скелетно-мышечных и метаболических проявлениях системного воспаления.
IL–17A играет ключевую роль в воспалительных путях, общих для кардиометаболических нарушений и Сп А. IL–17A в основном продуцируется Т-хелперными клетками 17 (Th17), активация, пролиферация и выживание которых управляются IL–23. Другие клеточные источники IL–17A включают в себя адаптивные иммунные клетки и врожденные иммунные клетки, такие как врожденные лимфоидные клетки типа 3 [ILC3], γδ Т-клетки и инвариантные естественные Т-киллеры [iNKT]. Несмотря на важную роль IL–17A в стимулировании воспаления и защите организма от специфических патогенов, известно, что повышенная экспрессия IL–17A является патофизиологическим звеном ряда хронических воспалительных заболеваний, включая ПсА и аксСпА. Известно, что метаболические нарушения, являющиеся частыми сопутствующими заболеваниями у пациентов со СпА, механически коррелируют с хроническим воспалительным статусом. IL–17A является ключевым участником нескольких патологических процессов, приводящих к метаболическому синдрому. Повышение экспрессии IL–17A у пациентов с ПсА и аксСпА может быть ключевым фактором в метаболически связанном воспалительном профиле, объясняя высокую распространенность кардиометаболических сопутствующих заболеваний среди пациентов со Сп А.
Несмотря на важную роль IL–17A в стимулировании воспаления и защите организма от специфических патогенов, известно, что повышенная экспрессия IL–17A участвует в патофизиологии некоторых хронических воспалительных заболеваний, включая ПсА и аксСпА58. У пациентов со СпА отмечаются повышенные уровни IL–17A и IL–23 в сыворотке крови58. У пациентов с ПсА наблюдается увеличение количества клеток Th17 в крови и синовиальной жидкости54 , при этом количество синовиальных клеток Th17 коррелирует с уровнями СРБ, скоростью оседания эритроцитов и показателем активности заболевания 28 (DAS28)55. У пациентов с ПсА также обнаружены высокие уровни рецепторов IL–23, IL–17A и IL–17 в синовиальных мембранах и сверхэкспрессия IL–17 (и IL–22) в энтез-резидентных клетках Th1754, 58. У пациентов с АС больше, чем у пациентов с остеоартритом, секретирующих IL–17 клеток в фасеточных суставах и выше уровень IL–17 в сыворотке по сравнению со здоровыми людьми, при этом уровень IL–17 в сыворотке и активность заболевания по индексу BASDAI имеют значительную положительную корреляцию51, 55, 58. В генах, непосредственно участвующих в передаче сигналов IL–17 у пациентов с ПсА или АС, были идентифицированы несколько однонуклеотидных полиморфизмов57.
Активация оси IL–23/IL–17 у пациентов со СпА запускает воспаление суставов и ремоделирование тканей посредством нескольких механизмов. Рекрутингу нейтрофилов в суставные пространства способствует продукция гранулоцитарно-колониестимулирующего фактора, гранулоцитарно-макрофагостимулирующего фактора и хемокинов54. Стимуляция оси IL–23/IL–17 также способствует ангиогенезу, тем самым облегчая приток воспалительных клеток в воспаленные ткани58. Другие механизмы включают усиление транскрипции генов, которые способствуют секреции ферментов, разрушающих костный матрикс, включая матриксную металлопротеиназу-9, тартрат-резистентную кислую фосфатазу и катепсин К54, 58 , стимуляцию дифференцировки остеокластов, резорбирующих кость58, 59 , а также стимуляцию дифференцировки остеобластов и образования энтезиальной кости59.
Известно, что метаболические нарушения, которые являются частыми сопутствующими заболеваниями у пациентов со СпА, механически коррелируют с хроническим воспалительным статусом (рисунок 2). Все больше данных свидетельствует о том, что активация оси IL–23/IL–17 у пациентов с ПсА и аксСпА может быть ключевым фактором высокой распространенности кардиометаболических сопутствующих заболеваний среди пациентов со Сп А. Лица, страдающие ожирением, имеют более высокие уровни IL–23 и IL–17 в сыворотке крови, чем лица без избыточной массы тела60–62 , повышенный уровень IL–17 был обнаружен у пациентов с диабетом 1 и 2 типа, неалкогольной жировой болезнью печени и стеатогепатитом60–62. Более того, уровни рецепторов IL–17 в клетках печени и мышц коррелируют с резистентностью к инсулину у пациентов с ожирением63. Кроме того, было показано, что инфильтрация CD4+ Т-клеток, включая клетки Th17, способствует созданию провоспалительной среды и резистентности к инсулину в жировой ткани у людей с ожирением [64]. IL–17A, по‑видимому, также участвует в развитии жировой болезни печени, причем данные свидетельствуют о том, что ось IL–17 играет решающую роль в патогенезе стеатогепатита и прогрессировании фиброза65, 66.
Рисунок 2. Перекрестная связь между кардиометаболическими заболеваниями и лечением спондилоартрита. Существует двунаправленная взаимосвязь между эффектами биологических болезнь-модифицирующих антиревматических препаратов и кардиометаболическим профилем пациента, которую следует учитывать при принятии терапевтического решения у пациентов со СпА. СпА связан с высоким риском сопутствующих кардиометаболических заболеваний – ожирения, артериальной гипертензии, дислипидемии и сахарного диабета, известных под общим названием метаболический синдром (МС), и, следовательно, с повышенным риском сердечно-сосудистой заболеваемости и смертности. С одной стороны, кардиометаболические состояния пациентов оказывают заметное влияние на результаты лечения СпА, изменяя вероятность достижения неактивного статуса заболевания, устойчивость лечения или характер возникновения нежелательных явлений. С другой стороны, терапия СпА может по-разному изменять кардиометаболические параметры пациентов и сердечно-сосудистый риск. Следовательно, это взаимодействие нужно учитывать при выборе лучшей стратегии лечения.
Данные также свидетельствуют о том, что IL–17 влияет на сердечно-сосудистую систему. IL–17A способствует эндотелиальной дисфункции и окислительному стрессу67 , индуцирует апоптоз эндотелиальных клеток и кардиомиоцитов68, подавляет экспрессию проадипогенных факторов транскрипции и усиливает экспрессию антиадипогенных факторов60, ускоряет формирование атеросклеротических изменений68.
Таким образом, IL–17 играет гомеостатическую роль в стимулировании воспаления и защите организма от конкретных патогенов (например, поддержание барьерных функций кишечного эпителия, защиты от бактерий и грибков и т.д.), но в то же время, в зависимости от патологии и ее локализации, он также оказывает явное провоспалительное действие, например, на уровне кожи или энтезита, а также оказывает влияние на сердечно-сосудистую систему.
Терапия, нацеленная на интерлейкин-17: положительные эффекты, выходящие за рамки контроля заболевания
Описанные выше данные позволяют предположить, что лечение СпА, нацеленное на IL–17, и последующее уменьшение воспаления также может помочь в контроле кардиометаболических сопутствующих заболеваний. Недавно для лечения СпА были одобрены ингибиторы других молекулярных мишеней, такие как JAK/STAT69 ; однако до сих пор нет данных о том, как сопутствующие кардиометаболические заболевания влияют на их эффективность и устойчивость. Профиль безопасности ингибиторов JAK/STAT у пациентов с повышенным риском сердечно-сосудистой и венозной тромбоэмболии в настоящее время пересматривается из-за данных о возможном увеличении сердечно-сосудистых и тромбоэмболических событий, поэтому у таких пациентов их следует использовать с осторожностью19, 70, 71.
Влияние лечения, нацеленного на интерлейкин-17, на кардиометаболические параметры
Исследования показывают, что терапия, нацеленная на IL–17, может снизить маркеры воспаления и сердечно-сосудистый риск. В объединенном анализе 19 клинических исследований секукинумаба у пациентов с псориазом, ПсА и аксСпА быстрое снижение маркеров воспаления произошло через 12–16 недель лечения, тогда как все традиционные факторы сердечно-сосудистого риска — ИМТ, уровень глюкозы натощак, артериальное давление, уровень холестерина ЛПНП, общий холестерин (ОХ), холестерин липопротеинов высокой плотности (ЛПВП-Х) и триглицериды (ТГ) – оставались стабильными через 1 год72. Исследование пациентов с ПсА показало значительное снижение уровня некоторых адипоцитокинов (резистина и хемерина) при приеме секукинумаба только у пациентов мужского пола, а также отсутствие различий в уровнях адипонектина или СРБ в течение первых 6 месяцев лечения73.
В обсервационном исследовании изучалось влияние различных биологических препаратов (анти-ФНО, ингибиторов IL–12/23 и IL–17) по сравнению с небиологической терапией на образование коронарных бляшек у пациентов с тяжелым псориазом74. Через 1 год лечения наблюдалось снижение количества некальцифицированных коронарных бляшек на 6% и значительное улучшение их морфологии при терапии биологическими препаратами по сравнению с небиологической терапией. При этом самое значительное уменьшение количества некальцифицированных бляшек наблюдалось у пациентов, получавших ингибиторы IL–1774. Другие авторы сообщили об уменьшении толщины интимы артерий у пациентов с тяжелым псориазом, получавших ингибитор IL–17A75. Исследование «Оценка маркеров сердечно-сосудистого риска у пациентов с псориазом, получавших секукинумаб» также показало, что секукинумаб может оказывать благотворное влияние на риск сердечно-сосудистых заболеваний за счет улучшения функции эндотелия у пациентов с псориазом76.
Влияние таргетной терапии IL–17 на маркеры сердечно-сосудистого риска изучалось в основном у пациентов с псориазом, но, учитывая общие патофизиологические механизмы, возможно, что эти эффекты могут также возникать при ПсА (или даже аксСпА).
Влияние других биологических препаратов на кардиометаболические параметры
В нескольких исследованиях оценивалось влияние различных биологических DMARD на кардиометаболические параметры и сердечно-сосудистый риск у пациентов с ПсА или псориазом. В когортном исследовании у пациентов с псориазом или ПсА не было выявлено существенных различий между терапией устекинумабом и анти-ФНО в отношении риска фибрилляции предсердий или серьезных неблагоприятных сердечно-сосудистых событий (MACE)77. Напротив, другое когортное исследование у пациентов с ПсА, которые впервые использовали биологические DMARD, показало больший риск MACE при терапии ингибиторами IL–23 и IL–17 по сравнению с анти-ФНО и ингибиторами ФДЭ-478. Однако это исследование не учитывало ряд факторов, таких как тяжесть заболевания, ожирение, курение, семейные факторы риска или прием НПВП78.
Существуют противоречивые данные о влиянии анти-ФНО на липидный профиль и риск сердечно-сосудистых событий: некоторые исследования показывают кардиопротекторный эффект анти-ФНО, а другие сообщают об отсутствии значительного эффекта79–84. В когортном исследовании 238 пациентов с аксСпА не было выявлено существенных различий в профиле атерогенных липидов у пациентов, принимавших и не принимавших анти-ФНО85. Другое исследование показало, что терапия анти-ФНО была связана с улучшением сосудистых показателей86 , но никаких изменений в липидном профиле тех же пациентов после 1 года лечения не наблюдалось87. Ретроспективное исследование у пациентов с аксСпА показало снижение сердечно-сосудистого риска при терапии анти-ФНО, но эта связь была незначительной после поправки на скорость оседания эритроцитов и уровни СРБ что позволяет предположить, что наблюдаемое снижение было связано с контролем воспаления, а не с каким‑либо специфичным для анти-ФНО эффектом88.
В когортном исследовании пациентов с АС, ПсА или РА риск сердечно-сосудистых событий был ниже у тех, кто лечился анти-ФНО и другими биологическими DMARD, кроме пациентов, прекративших биологическую терапию89. Другое исследование, оценивающее риск инфаркта миокарда, инсульта и реваскуляризации у пациентов с ПсА, принимавших ФНО или другие биологические препараты, показало самую низкую частоту инфаркта миокарда у пациентов, получавших анти-ФНО90.
В одном систематическом обзоре и метаанализе девяти наблюдательных исследований у пациентов с АС не было выявлено значимой связи между терапией анти-ФНО и частотой инфаркта миокарда91. Другой систематический обзор и метаанализ показали снижение риска сердечно-сосудистых событий среди пациентов с псориазом или ПсА, получавших противоревматические препараты, включая анти-ФНО92. Обновленный метаанализ влияния ФНО на неблагоприятные сердечно-сосудистые события у пациентов с псориазом (с ПсА или без него) выявил значительно более низкий сердечно-сосудистый риск при применении ФНО по сравнению с местной/фототерапией93.
При этом ряд данных указывает на негативное влияние лечения анти-ФНО на состав тела, вес и ИМТ94–96. У пациентов со СпА двухлетняя терапия анти-ФНО была связана со значительным увеличением по сравнению с исходным уровнем среднего ИМТ и жировой массы94. Более того, у этих пациентов также наблюдалось значительное увеличение по сравнению с исходным уровнем средней окружности талии, количества висцеральной и подкожной жировой клетчатки94. Аналогично, в исследовании пациентов с РА или АС наблюдалось увеличение массы тела, ИМТ, общей жировой массы после 2 лет лечения анти-ФНО95. У пациентов с псориазом, получавших анти-ФНО (этанерцепт и инфликсимаб) или метотрексат в течение 6 месяцев, значительное увеличение веса и ИМТ по сравнению с исходным уровнем наблюдалось у пациентов, получавших анти-ФНО, тогда как незначительные изменения наблюдались у пациентов, получавших метотрексат97. В исследовании пациентов со СпА после 3 месяцев приема анти-ФНО наблюдалось одновременное увеличение сывороточного инсулиноподобного фактора роста-I96.
Эффективность и устойчивость ингибиторов интерлейкина-17 у пациентов с сопутствующими кардиометаболическими заболеваниями
В проспективном исследовании пациентов с ПсА, получавших секукинумаб, с избыточным весом/ожирением или нормальным весом, у пациентов с ожирением после 6 месяцев лечения наблюдались более высокие концентрации секукинумаба в крови по сравнению с пациентами с нормальным весом98. Это исследование выявило обратную корреляцию между активностью заболевания и ИМТ, что позволяет предположить, что пациенты с избыточным весом и ожирением, возможно, имели лучший ответ к лечению секукинумабом, чем пациенты с нормальным весом98.
Сопутствующие кардиометаболические заболевания не оказывают негативного влияния на показатели удержания терапии секукинумабом. В обсервационном исследовании SECASTUR у пациенты с аксСпА или ПсА, с ожирением или диабетом реже прекращали лечение секукинумабом, уровень удержания составил 66%99. В другом исследовании испанских пациентов с ПсА или аксСпА уровень удержания секукинумаба составил 71% после 1 года лечения; лучшие показатели удержания наблюдались у женщин с аксСпА и мужчин с ПсА100.
Эффективность и устойчивость других биологических препаратов у пациентов с сопутствующими кардиометаболическими заболеваниями
Хотя наличие ожирения, по‑видимому, улучшало или не влияло на эффективность секукинумаба и устойчивость лечения, исследования показывают, что у пациентов с ожирением может быть плохой ответ на устекинумаб или анти-ФНО и выше вероятность прекращения лечения.
Эффективность и уровень удержания анти-ФНО у пациентов с кардиометаболическими нарушениями изучались в нескольких исследованиях, в которых пациенты с ожирением имели худший ответ и с большей вероятностью прекращали лечение, чем пациенты с нормальным весом101–103. В когортном исследовании швейцарских пациентов аксСпА, получавших анти-ФНО в качестве терапии первой линии, у пациентов с ожирением были значительно меньшие шансы достижения ответа ASAS40 по сравнению с пациентами с нормальным весом104. Исследование с участием китайских пациентов с АС, получавших различные биологические препараты, показало значительную отрицательную корреляцию между активностью заболевания и ИМТ после 3, 6, 9 и 12 месяцев лечения анти-ФНО [105]. В итальянской когорте пациентов с ПсА наличие МС было связано с более низкой вероятностью достижения MDA после 24 месяцев лечения анти-ФНО106. Результаты регистров DANBIO (Дания) и ICEBIO (Исландия) показали, что у пациентов с ПсА и ожирением, получавших анти-ФНО, активность заболевания была выше, т.е. снижались шансы достижения хорошего или умеренного ответа EULAR, снижался клинический ответ и отмечалась худшая приверженность лечению после 18 месяцев лечения по сравнению с пациентами без ожирения107. Напротив, исследование Янонна и его коллег не выявило существенных различий в активности заболевания между пациентами с ПсА с ожирением и без него, получавшими анти-ФНО108. Это несоответствие может быть вызвано ретроспективным характером исследования и критериями включения/исключения, используемыми для определения исследуемой популяции108.
Плохой клинический ответ на анти-ФНО среди пациентов с ожирением также был подтвержден в метаанализах. В систематическом обзоре и метаанализе шансы на достижение хорошего ответа или клинической ремиссии (улучшение BASDAI на 50%) при использовании анти-ФНО были ниже у пациентов с ожирением аксСпА по сравнению с пациентами без ожирения109. В другом систематическом обзоре исследований пациентов с ПсА, получавших анти-ФНО (устекинумаб, абатацепт или апремиласт), пациенты с ожирением имели более высокую вероятность достижения 20% улучшения по критериям Американской коллегии ревматологов (ACR20), но значительно более высокие шансы прекращения лечения, чем у пациентов без ожирения110.
Существует множество литературы об ожирении и его пагубном влиянии на эффективность анти-ФНО у пациентов со СпА, но данных о влиянии потери веса на активность заболевания недостаточно. В исследовании пациентов с ПсА с избыточным весом/ожирением, получавших анти-ФНО на фоне диеты, потеря веса ≥5% от исходного уровня была связана со значительно более высокими показателями достижения MDA через 6 месяцев наблюдения по сравнению с потерей веса <5% [47]. Другое исследование пациентов с псориазом, страдающих ожирением, получавших анти-ФНО, показало, что диета привела к значительной потере веса и значительному улучшению активности заболевания (индекс площади и тяжести псориаза 75 [PASI 75]) на 24 неделе по сравнению с отсутствием диеты111.
Выводы
Между эффектами биологических DMARD и кардиометаболическим профилем пациента существует двунаправленная связь, которую необходимо учитывать при принятии решения о лечении пациентов со спондилоартритом. Биологическая терапия может вызвать изменения в кардиометаболическом статусе пациентов и повлиять на клинический ответ на лечение. Несмотря на то, что доказательства о влиянии ингибиторов IL–17 на кардиометаболический профиль ограничены, доступные данные свидетельствуют о том, что терапия секукинумабом не усугубляет традиционные маркеры сердечно-сосудистого риска и может быть связана со снижением сердечно-сосудистых событий. Секукинумаб столь же эффективен у пациентов с ожирением, как и у пациентов без ожирения и уровень удержания терапии у пациентов со спондилоартритом и ожирением остается высоким.
Имеется множество данных о влиянии анти-ФНО на кардиометаболический профиль. В основном они связаны с увеличением массы тела и процента жировой ткани, а также с худшими клиническими ответами и увеличением частоты прекращения лечения у пациентов с ожирением. Несмотря на то, что на сегодняшний день отсутствуют сравнительные рандомизированные клинические исследования, эти данные позволяют предположить, что пациенты с аксСпА или ПсА и кардиометаболическими расстройствами могут получить пользу от терапии, нацеленной на IL–17A, при этом секукинумаб является единственным ингибитором IL–17A, который на данный момент продемонстрировал такие преимущества.
Список литературы
- Stolwijk C, van Onna M, Boonen A, van Tubergen A. Global prevalence of spondyloarthritis: a systematic review and meta-regression analysis. Arthritis Care Res (Hoboken) (2016) 68(9):1320–31. doi: 10.1002/acr.22831
- Rudwaleit M, van der Heijde D, Landewé R, Akkoc N, Brandt J, Chou CT, et al. The assessment of spondyloarthritis international society classification criteria for peripheral spondyloarthritis and for spondyloarthritis in general. Ann Rheum Dis (2011) 70(1):25–31. doi: 10.1136/ard.2010.133645
- Sieper J, Poddubnyy D. Axial spondyloarthritis. Lancet (2017) 390(10089):73–84. doi: 10.1016/s0140–6736(16)31591–4
- Veale DJ, Fearon U. The pathogenesis of psoriatic arthritis. Lancet (2018) 391(10136):2273–84. doi: 10.1016/s0140–6736(18)30830–4
- Coates LC, Helliwell PS. Psoriatic arthritis: state of the art review. Clin Med (Lond) (2017) 17(1):65–70. doi: 10.7861/clinmedicine.17–1-65 [PMC free article]
- Ward MM, Deodhar A, Gensler LS, Dubreuil M, Yu D, Khan MA, et al. Update of the American college of Rheumatology/Spondylitis association of America/Spondyloarthritis research and treatment network recommendations for the treatment of ankylosing spondylitis and nonradiographic axial spondyloarthritis. Arthritis Care Res (Hoboken) (2019) 71(10):1285–99. doi: 10.1002/acr.24025
- Ogdie A, Coates LC, Gladman DD. Treatment guidelines in psoriatic arthritis. Rheumatol (Oxford) (2020) 59(Suppl 1):i37–46. doi: 10.1093/rheumatology/kez383
- Ritchlin C, Adamopoulos IE. Axial spondyloarthritis: new advances in diagnosis and management. BMJ (2021) 372:m4447. doi: 10.1136/bmj.m4447
- Coates LC, Helliwell PS. Methotrexate efficacy in the tight control in psoriatic arthritis study. J Rheumatol (2016) 43(2):356–61. doi: 10.3899/jrheum.150614
- Kerschbaumer A, Smolen JS, Dougados M, de Wit M, Primdahl J, McInnes I, et al. Pharmacological treatment of psoriatic arthritis: a systematic literature research for the 2019 update of the EULAR recommendations for the management of psoriatic arthritis. Ann Rheum Dis (2020) 79(6):778–86. doi: 10.1136/annrheumdis-2020–217163
- Phillips R. Bimekizumab safe and effective for AS and PsA in long-term trials. Nat Rev Rheumatol (2022) 18(9):494. doi: 10.1038/s41584–022–00823–2
- Fragoulis GE, Siebert S. The role of IL–23 and the use of IL–23 inhibitors in psoriatic arthritis. Musculoskeletal Care (2022) 20 Suppl 1:S12-s21. doi: 10.1002/msc.1694
- Webers C, Ortolan A, Sepriano A, Falzon L, Baraliakos X, Landewé RBM, et al. Efficacy and safety of biological DMARDs: a systematic literature review informing the 2022 update of the ASAS-EULAR recommendations for the management of axial spondyloarthritis. Ann Rheum Dis (2023) 82(1):130–41. doi: 10.1136/ard-2022–223298
- Moltó A, Nikiphorou E. Comorbidities in spondyloarthritis. Front Med (Lausanne) (2018) 5:62. doi: 10.3389/fmed.2018.00062
- Porta S, Otero-Losada M, Kölliker Frers RA, Cosentino V, Kerzberg E, Capani F. Adipokines, cardiovascular risk, and therapeutic management in obesity and psoriatic arthritis. Front Immunol (2020) 11:590749. doi: 10.3389/fimmu.2020.590749
- Toussirot E. The risk of cardiovascular diseases in axial spondyloarthritis. Curr Insights Front Med (Lausanne) (2021) 8:782150. doi: 10.3389/fmed.2021.782150
- Queiro R. Cardiometabolic comorbidity in the selection of treatment in spondyloarthritis: one step closer to truly personalized medicine? Expert Opin Biol Ther (2021) 21(12):1539–41. doi: 10.1080/14712598.2022.1998448
- Gossec L, Baraliakos X, Kerschbaumer A, de Wit M, McInnes I, Dougados M, et al. EULAR recommendations for the management of psoriatic arthritis with pharmacological therapies: 2019 update. Ann Rheum Dis (2020) 79(6):700–12. doi: 10.1136/annrheumdis-2020–217159
- Coates LC, Soriano ER, Corp N, Bertheussen H, Callis Duffin K, Campanholo CB, et al. Group for research and assessment of psoriasis and psoriatic arthritis (GRAPPA): updated treatment recommendations for psoriatic arthritis 2021. Nat Rev Rheumatol (2022) 18(8):465–79. doi: 10.1038/s41584–022–00798–0
- van der Heijde D, Ramiro S, Landewé R, Baraliakos X, Van den Bosch F, Sepriano A, et al. Update of the ASAS-EULAR management recommendations for axial spondyloarthritis. Ann Rheum Dis (2016) 76(6):978–91. doi: 10.1136/annrheumdis-2016–210770
- Agca R, Heslinga SC, Rollefstad S, Heslinga M, McInnes IB, Peters MJ, et al. EULAR recommendations for cardiovascular disease risk management in patients with rheumatoid arthritis and other forms of inflammatory joint disorders: 2015/2016 update. Ann Rheum Dis (2017) 76(1):17–28. doi: 10.1136/annrheumdis-2016–209775
- Caso F, Chimenti MS, Navarini L, Ruscitti P, Peluso R, Girolimetto N, et al. Metabolic syndrome and psoriatic arthritis: considerations for the clinician. Expert Rev Clin Immunol (2020) 16(4):409–20. doi: 10.1080/1744666x.2020.1740593
- Genre F, López-Mejías R, Miranda-Filloy JA, Ubilla B, Carnero-López B, Blanco R, et al. Adipokines, biomarkers of endothelial activation, and metabolic syndrome in patients with ankylosing spondylitis. BioMed Res Int (2014) 2014:860651. doi: 10.1155/2014/860651
- Puig L. Cardiometabolic comorbidities in psoriasis and psoriatic arthritis. Int J Mol Sci (2017) 19(1):58. doi: 10.3390/ijms19010058
- Russolillo A, Iervolino S, Peluso R, Lupoli R, Di Minno A, Pappone N, et al. Obesity and psoriatic arthritis: from pathogenesis to clinical outcome and management. Rheumatol (Oxford) (2013) 52(1):62–7. doi: 10.1093/rheumatology/kes242
- Verhoeven F, Prati C, Demougeot C, Wendling D. Cardiovascular risk in psoriatic arthritis, a narrative review. Joint Bone Spine (2020) 87(5):413–8. doi: 10.1016/j.jbspin.2019.12.004 [PubMed] [CrossRef] [Google Scholar]
- Landgren AJ, Bilberg A, Eliasson B, Larsson I, Dehlin M, Jacobsson L, et al. Cardiovascular risk factors are highly overrepresented in Swedish patients with psoriatic arthritis compared with the general population. Scand J Rheumatol (2020) 49(3):195–9. doi: 10.1080/03009742.2019.1672783
- Landgren AJ, Dehlin M, Jacobsson L, Bergsten U, Klingberg E. Cardiovascular risk factors in gout, psoriatic arthritis, rheumatoid arthritis and ankylosing spondylitis: a cross-sectional survey of patients in Western Sweden. RMD Open (2021) 7(2):e001568. doi: 10.1136/rmdopen-2021–001568
- Queiro R, Lorenzo A, Tejón P, Coto P, Pardo E. Obesity in psoriatic arthritis: comparative prevalence and associated factors. Med (Baltimore) (2019) 98(28):e16400. doi: 10.1097/md.0000000000016400
- Queiro R, Lorenzo A, Tejón P, Pardo E, Coto P, Ballina J. Polyarticular evolution and late-onset psoriasis may be associated with cardiovascular disease in psoriatic arthritis. Int J Rheum Dis (2019) 22(2):269–74. doi: 10.1111/1756–185x.13421
- Lai Y, Zhang Y, Mo S, Ma J, Ni T, Lei Z, et al. Prevalence of comorbidities and risk factors in spondyloarthritis: results of a cross-sectional study. Ann Rheum Dis (2022) 81(3):e43. doi: 10.1136/annrheumdis-2020–217313
- Labitigan M, Bahče-Altuntas A, Kremer JM, Reed G, Greenberg JD, Jordan N, et al. Higher rates and clustering of abnormal lipids, obesity, and diabetes mellitus in psoriatic arthritis compared with rheumatoid arthritis. Arthritis Care Res (Hoboken) (2014) 66(4):600–7. doi: 10.1002/acr.22185
- Feld J, Nissan S, Eder L, Rahat MA, Elias M, Rimar D, et al. Increased prevalence of metabolic syndrome and adipocytokine levels in a psoriatic arthritis cohort. J Clin Rheumatol (2018) 24(6):302–7. doi: 10.1097/rhu.0000000000000721
- Loganathan A, Kamalaraj N, El-Haddad C, Pile K. Systematic review and meta-analysis on prevalence of metabolic syndrome in psoriatic arthritis, rheumatoid arthritis and psoriasis. Int J Rheum Dis (2021) 24(9):1112–20. doi: 10.1111/1756–185x.14147
- Zhao SS, Robertson S, Reich T, Harrison NL, Moots RJ, Goodson NJ. Prevalence and impact of comorbidities in axial spondyloarthritis: systematic review and meta-analysis. Rheumatology (2020) 59(Supplement_4):iv47–57. doi: 10.1093/rheumatology/keaa246
- Caso F, Navarini L, Carubbi F, Picchianti-Diamanti A, Chimenti MS, Tasso M, et al. Mediterranean Diet and psoriatic arthritis activity: a multicenter cross-sectional study. Rheumatol Int (2020) 40(6):951–8. doi: 10.1007/s00296–019–04458–7
- Popa SL, Dumitrascu DI, Brata VD, Duse TA, Florea MD, Ismaiel A, et al. Nutrition in spondyloarthritis and related immune-mediated disorders. Nutrients (2022) 14(6):1278. doi: 10.3390/nu14061278
- Scriffignano S, Lories R, Nzeusseu Toukap A, Lubrano E, Ciccia F, Steinfeld S, et al. Cardiovascular comorbidities in psoriatic arthritis: epidemiology and risk factors in two different European populations. Clin Exp Rheumatol (2023). doi: 10.55563/clinexprheumatol/aovika
- Martínez-González MA, Gea A, Ruiz-Canela M. The Mediterranean diet and cardiovascular health. Circ Res (2019) 124(5):779–98. doi: 10.1161/CIRCRESAHA.118.313348
- Ferraz-Amaro I, Genre F, Blanco R, Corrales A, González Mazón I, Portilla V, et al. Sex differences in cardiovascular and disease-related features in axial spondyloarthritis. a multicenter study of 912 patients. Semin Arthritis Rheum (2023) 60:152198. doi: 10.1016/j.semarthrit.2023.152198
- Gok K, Nas K, Tekeoglu I, Sunar I, Keskin Y, Kilic E, et al. Impact of obesity on quality of life, psychological status, and disease activity in psoriatic arthritis: a Multi−Center study. Rheumatol Int (2022) 42(4):659–68. doi: 10.1007/s00296–021–04971–8
- Liew JW, Gianfrancesco MA, Heckbert SR, Gensler LS. Relationship between body mass index, disease activity, and exercise in ankylosing spondylitis. Arthritis Care Res (Hoboken) (2022) 74(8):1287–93. doi: 10.1002/acr.24565
- Bindesbøll C, Garrido-Cumbrera M, Bakland G, Dagfinrud H. Obesity increases disease activity of Norwegian patients with axial spondyloarthritis: results from the European map of axial spondyloarthritis survey. Curr Rheumatol Rep (2020) 22(8):43. doi: 10.1007/s11926–020–00917–4
- Chen CH, Chen HA, Liu CH, Liao HT, Chou CT, Chen CH. Association of obesity with inflammation, disease severity and cardiovascular risk factors among patients with ankylosing spondylitis. Int J Rheum Dis (2020) 23(9):1165–74. doi: 10.1111/1756–185x.13912
- Liew JW, Huang IJ, Louden DN, Singh N, Gensler LS. Association of body mass index on disease activity in axial spondyloarthritis: systematic review and meta-analysis. RMD Open (2020) 6(1):e001225. doi: 10.1136/rmdopen-2020–001225
- Bakirci S, Dabague J, Eder L, McGonagle D, Aydin SZ. The role of obesity on inflammation and damage in spondyloarthritis: a systematic literature review on body mass index and imaging. Clin Exp Rheumatol (2020) 38(1):144–8.
- Di Minno MN, Peluso R, Iervolino S, Russolillo A, Lupoli R, Scarpa R. Weight loss and achievement of minimal disease activity in patients with psoriatic arthritis starting treatment with tumour necrosis factor α blockers. Ann Rheum Dis (2014) 73(6):1157–62. doi: 10.1136/annrheumdis-2012–202812
- Klingberg E, Bilberg A, Björkman S, Hedberg M, Jacobsson L, Forsblad-d’Elia H, et al. Weight loss improves disease activity in patients with psoriatic arthritis and obesity: an interventional study. Arthritis Res Ther (2019) 21(1):17. doi: 10.1186/s13075–019–1810–5 [PMC free article]
- Klingberg E, Björkman S, Eliasson B, Larsson I, Bilberg A. Weight loss is associated with sustained improvement of disease activity and cardiovascular risk factors in patients with psoriatic arthritis and obesity: a prospective intervention study with two years of follow-up. Arthritis Res Ther (2020) 22(1):254. doi: 10.1186/s13075–020–02350–5
- Ferguson LD, Siebert S, McInnes IB, Sattar N. Cardiometabolic comorbidities in RA and PsA: lessons learned and future directions. Nat Rev Rheumatol (2019) 15(8):461–74. doi: 10.1038/s41584–019–0256–0
- Torgutalp M, Poddubnyy D. IL–17 inhibition in axial spondyloarthritis: current and future perspectives. Expert Opin Biol Ther (2019) 19(7):631–41. doi: 10.1080/14712598.2019.1605352
- Sieper J, Poddubnyy D, Miossec P. The IL–23–IL–17 pathway as a therapeutic target in axial spondyloarthritis. Nat Rev Rheumatol (2019) 15(12):747–57. doi: 10.1038/s41584–019–0294–7
- Groen SS, Sinkeviciute D, Bay-Jensen AC, Thudium CS, Karsdal MA, Thomsen SF, et al. Exploring IL–17 in spondyloarthritis for development of novel treatments and biomarkers. Autoimmun Rev (2021) 20(3):102760. doi: 10.1016/j.autrev.2021.102760
- Blauvelt A, Chiricozzi A. The immunologic role of IL–17 in psoriasis and psoriatic arthritis pathogenesis. Clin Rev Allergy Immunol (2018) 55(3):379–90. doi: 10.1007/s12016–018–8702–3
- Tsukazaki H, Kaito T. The role of the IL–23/IL–17 pathway in the pathogenesis of spondyloarthritis. Int J Mol Sci (2020) 21(17):6401. doi: 10.3390/ijms21176401
- Raychaudhuri SP, Raychaudhuri SK. Mechanistic rationales for targeting interleukin-17A in spondyloarthritis. Arthritis Res Ther (2017) 19(1):51. doi: 10.1186/s13075–017–1249–5
- McGonagle DG, McInnes IB, Kirkham BW, Sherlock J, Moots R. The role of IL–17A in axial spondyloarthritis and psoriatic arthritis: recent advances and controversies. Ann Rheum Dis (2019) 78(9):1167–78. doi: 10.1136/annrheumdis-2019–215356
- 58 Taams LS, Steel KJA, Srenathan U, Burns LA, Kirkham BW. IL–17 in the immunopathogenesis of spondyloarthritis. Nat Rev Rheumatol (2018) 14(8):453–66. doi: 10.1038/s41584–018–0044–2
- Gravallese EM, Schett G. Effects of the IL–23–IL–17 pathway on bone in spondyloarthritis. Nat Rev Rheumatol (2018) 14(11):631–40. doi: 10.1038/s41584–018–0091–8
- Chehimi M, Vidal H, Eljaafari A. Pathogenic role of IL–17-Producing immune cells in obesity, and related inflammatory diseases. J Clin Med (2017) 6(7):68. doi: 10.3390/jcm6070068
- Egeberg A, Gisondi P, Carrascosa JM, Warren RB, Mrowietz U. The role of the interleukin-23/Th17 pathway in cardiometabolic comorbidity associated with psoriasis. J Eur Acad Dermatol Venereol (2020) 34(8):1695–706. doi: 10.1111/jdv.16273
- Zafiriou E, Daponte AI, Siokas V, Tsigalou C, Dardiotis E, Bogdanos DP. Depression and obesity in patients with psoriasis and psoriatic arthritis: is IL–17–Mediated immune dysregulation the connecting link? Front Immunol (2021) 12:699848. doi: 10.3389/fimmu.2021.699848
- Fabbrini E, Cella M, McCartney SA, Fuchs A, Abumrad NA, Pietka TA, et al. Association between specific adipose tissue CD4+ T-cell populations and insulin resistance in obese individuals. Gastroenterology (2013) 145(2):366–74 e1–3. doi: 10.1053/j.gastro.2013.04.010
- McLaughlin T, Liu L-F, Lamendola C, Shen L, Morton J, Rivas H, et al. T-Cell profile in adipose tissue is associated with insulin resistance and systemic inflammation in humans. Arterioscler Thromb Vasc Biol (2014) 34(12):2637–43. doi: 10.1161/ATVBAHA.114.304636
- Giles DA, Moreno-Fernandez ME, Divanovic S. IL–17 axis driven inflammation in non-alcoholic fatty liver disease progression. Curr Drug Targets (2015) 16(12):1315–23. doi: 10.2174/1389450116666150531153627
- Hatting M, Tacke F. From NAFLD to HCC: is IL–17 the crucial link? Hepatology (2017) 65(2):739–41. doi: 10.1002/hep.28934
- Rodrigues-Diez RR, Tejera-Muñoz A, Orejudo M, Marquez-Exposito L, Santos L, Rayego-Mateos S, et al. Interleukin-17A: possible mediator and therapeutic target in hypertension. Nefrologia (Engl Ed) (2021) 41(3):244–57. doi: 10.1016/j.nefro.2020.11.009
- Ruiz de Morales JMG, Puig L, Daudén E, Cañete JD, Pablos JL, Martín AO, et al. Critical role of interleukin (IL)-17 in inflammatory and immune disorders: an updated review of the evidence focusing in controversies. Autoimmun Rev (2020) 19(1):102429. doi: 10.1016/j.autrev.2019.102429
- Campanaro F, Batticciotto A, Zaffaroni A, Cappelli A, Donadini MP, Squizzato A, et al. And psoriatic arthritis: a systematic review and meta-analysis. Autoimmun Rev (2021) 20(10):102902. doi: 10.1016/j.autrev.2021.102902
- European Medicines Agency. EMA confirms measures to minimise risk of serious side effects with janus kinase inhibitors for chronic inflammatory disorders (2022). Available at: https://www.ema.europa.eu/en/documents/referral/janus-kinase-inhibitors-... (Accessed 2022 December 6).
- Ramiro S, Nikiphorou E, Sepriano A, Ortolan A, Webers C, Baraliakos X, et al. ASAS-EULAR recommendations for the management of axial spondyloarthritis: 2022 update. Ann Rheum Dis (2023) 82(1):19–34. doi: 10.1136/ard-2022–223296
- Merola JF, McInnes IB, Deodhar AA, Dey AK, Adamstein NH, Quebe-Fehling E, et al. Effect of secukinumab on traditional cardiovascular risk factors and inflammatory biomarkers: Post hoc analyses of pooled data across three indications. Rheumatol Ther (2022) 9(3):935–55. doi: 10.1007/s40744–022–00434-z
- Fassio A, Gatti D, Gisondi P, Girolomoni G, Viapiana O, Giollo A, et al. Effects of secukinumab on serum adipocytokines: preliminary data. Reumatismo (2017) 69(3):105–10. doi: 10.4081/reumatismo.2017.953
- Elnabawi YA, Dey AK, Goyal A, Groenendyk JW, Chung JH, Belur AD, et al. Coronary artery plaque characteristics and treatment with biologic therapy in severe psoriasis: results from a prospective observational study. Cardiovasc Res (2019) 115(4):721–8. doi: 10.1093/cvr/cvz009
- Piros EA, Szabo A, Rencz F, Brodszky V, Szalai K, Galajda N, et al. Impact of interleukin-17 inhibitor therapy on arterial intima-media thickness among severe psoriatic patients. Life (Basel) (2021) 11(9):919. doi: 10.3390/life11090919
- von Stebut E, Reich K, Thaci D, Koenig W, Pinter A, Körber A, et al. Impact of secukinumab on endothelial dysfunction and other cardiovascular disease parameters in psoriasis patients over 52 weeks. J Invest Dermatol (2019) 139(5):1054–62. doi: 10.1016/j.jid.2018.10.042
- Lee MP, Desai RJ, Jin Y, Brill G, Ogdie A, Kim SC. Association of ustekinumab vs TNF inhibitor therapy with risk of atrial fibrillation and cardiovascular events in patients with psoriasis or psoriatic arthritis. JAMA Dermatol (2019) 155(6):700–7. doi: 10.1001/jamadermatol.2019.0001
- Pina Vegas L, Le Corvoisier P, Penso L, Paul M, Sbidian E, Claudepierre P. Risk of major adverse cardiovascular events in patients initiating Biologics/Apremilast for psoriatic arthritis: a nationwide cohort study. Rheumatol (Oxford) (2022) 61(4):1589–99. doi: 10.1093/rheumatology/keab522
- Atzeni F, Nucera V, Galloway J, Zoltán S, Nurmohamed M. Cardiovascular risk in ankylosing spondylitis and the effect of anti-TNF drugs: a narrative review. Expert Opin Biol Ther (2020) 20(5):517–24. doi: 10.1080/14712598.2020.1704727
- Ingegnoli F, Gualtierotti R, Artusi C, Lubrano E. Focus on the potential effects of treatments for spondylarthritides on cardiovascular risk. Expert Rev Clin Immunol (2014) 10(2):307–15. doi: 10.1586/1744666x.2014.875468
- Liew JW, Ramiro S, Gensler LS. Cardiovascular morbidity and mortality in ankylosing spondylitis and psoriatic arthritis. Best Pract Res Clin Rheumatol (2018) 32(3):369–89. doi: 10.1016/j.berh.2019.01.002
- Shen J, Shang Q, Tam LS. Targeting inflammation in the prevention of cardiovascular disease in patients with inflammatory arthritis. Transl Res (2016) 167(1):138–51. doi: 10.1016/j.trsl.2015.05.006
- Wierzbowska-Drabik K, Lesiak A, Skibińska M, Niedźwiedź M, Kasprzak JD, Narbutt J. Psoriasis and atherosclerosis-skin, joints, and cardiovascular story of two plaques in relation to the treatment with biologics. Int J Mol Sci (2021) 22(19):10402. doi: 10.3390/ijms221910402 [PMC free article]
- Calvo Alen J, Lavin-Gomez BA, Aurrecoechea E, Guerra Ruiz AR, Martinez Taboada V, Gomez Gerique J. TNF inhibitors exert a «Hidden» beneficial effect in the cardiovascular lipoprotein profile of RA patients. Biologics (2022) 16:187–97. doi: 10.2147/BTT.S364191
- Min HK, Lee J, Ju JH, Park SH, Kwok SK. Impact of TNF-α inhibitor on lipid profile and atherogenic index of plasma in axial spondyloarthritis: 2-year follow-up data from the Catholic axial spondyloarthritis COhort (CASCO). Clin Rheumatol (2020) 39(2):471–7. doi: 10.1007/s10067–019–04767-z
- Végh E, Kerekes G, Pusztai A, Hamar A, Szamosi S, Váncsa A, et al. Effects of 1-year anti-TNF-α therapy on vascular function in rheumatoid arthritis and ankylosing spondylitis. Rheumatol Int (2020) 40(3):427–36. doi: 10.1007/s00296–019–04497–0
- Czókolyová M, Pusztai A, Végh E, Horváth Á, Szentpéteri A, Hamar A, et al. Changes of metabolic biomarker levels upon one-year anti-TNF-α therapy in rheumatoid arthritis and ankylosing spondylitis: associations with vascular pathophysiology. Biomolecules (2021) 11(10):1535. doi: 10.3390/biom11101535
- Kwon OC, Park MC. Effect of tumor necrosis factor inhibitors on risk of cardiovascular disease in patients with axial spondyloarthritis. Arthritis Res Ther (2022) 24(1):141. doi: 10.1186/s13075–022–02836–4
- Lee JL, Sinnathurai P, Buchbinder R, Hill C, Lassere M, March L. Biologics and cardiovascular events in inflammatory arthritis: a prospective national cohort study. Arthritis Res Ther (2018) 20(1):171. doi: 10.1186/s13075–018–1669-x
- Persson R, Hagberg KW, Qian Y, Vasilakis-Scaramozza C, Jick S. The risks of major cardiac events among patients with psoriatic arthritis treated with apremilast, biologics, DMARDs or corticosteroids. Rheumatol (Oxford England) (2021) 60(4):1926–31. doi: 10.1093/rheumatology/keaa683
- Karmacharya P, Shahukhal R, Crowson CS, Murad MH, Davis JM, 3rd, Shrestha P, et al. Effects of therapies on cardiovascular events in ankylosing spondylitis: a systematic review and meta-analysis. Rheumatol Ther (2020) 7(4):993–1009. doi: 10.1007/s40744–020–00248-x
- Roubille C, Richer V, Starnino T, McCourt C, McFarlane A, Fleming P, et al. The effects of tumour necrosis factor inhibitors, methotrexate, non-steroidal anti-inflammatory drugs and corticosteroids on cardiovascular events in rheumatoid arthritis, psoriasis and psoriatic arthritis: a systematic review and meta-analysis. Ann Rheum Dis (2015) 74(3):480–9. doi: 10.1136/annrheumdis-2014–206624
- Yang ZS, Lin NN, Li L, Li Y. The effect of TNF inhibitors on cardiovascular events in psoriasis and psoriatic arthritis: an updated meta-analysis. Clin Rev Allergy Immunol (2016) 51(2):240–7. doi: 10.1007/s12016–016–8560–9
- Hmamouchi I, Roux C, Paternotte S, Kolta S, Dougados M, Briot K. Early increase of abdominal adiposity in patients with spondyloarthritis receiving anti-tumor necrosis factor-α treatment. J Rheumatol (2014) 41(6):1112–7. doi: 10.3899/jrheum.131150
- Toussirot É, Mourot L, Dehecq B, Wendling D, Grandclément É, Dumoulin G. Tnfα blockade for inflammatory rheumatic diseases is associated with a significant gain in android fat mass and has varying effects on adipokines: a 2-year prospective study. Eur J Nutr (2014) 53(3):951–61. doi: 10.1007/s00394–013–0599–2
- Briot K, Garnero P, Le Henanff A, Dougados M, Roux C. Body weight, body composition, and bone turnover changes in patients with spondyloarthropathy receiving anti-tumour necrosis factor α treatment. Ann Rheum Dis (2005) 64(8):1137–40. doi: 10.1136/ard.2004.028670
- Gisondi P, Cotena C, Tessari G, Girolomoni G. Anti-tumour necrosis factor-alpha therapy increases body weight in patients with chronic plaque psoriasis: a retrospective cohort study. J Eur Acad Dermatol Venereol (2008) 22(3):341–4. doi: 10.1111/j.1468–3083.2007.02429.x
- Pantano I, Iacono D, Favalli EG, Scalise G, Costa L, Caso F, et al. Secukinumab efficacy in patients with PsA is not dependent on patients» body mass index. Ann Rheum Dis (2022) 81(3):e42. doi: 10.1136/annrheumdis-2020–217251
- Alonso S, Villa I, Fernández S, Martín JL, Charca L, Pino M, et al. Multicenter study of secukinumab survival and safety in spondyloarthritis and psoriatic arthritis: secukinumab in cantabria and Asturias study. Front Med (Lausanne) (2021) 8:679009. doi: 10.3389/fmed.2021.679009
- García-Dorta A, León-Suarez P, Peña S, Hernández-Díaz M, Rodríguez-Lozano C, González-Dávila E, et al. Association of gender, diagnosis, and obesity with retention rate of secukinumab in spondyloarthropathies: results form a multicenter real-world study. Front Med (Lausanne) (2021) 8:815881. doi: 10.3389/fmed.2021.815881
- Zurita Prada PA, Urrego Laurín CL, Guillén Astete CA, Kanaffo Caltelblanco S, Navarro-Compán V. Influence of smoking and obesity on treatment response in patients with axial spondyloarthritis: a systematic literature review. Clin Rheumatol (2021) 40(5):1673–86. doi: 10.1007/s10067–020–05319–6
- Ibáñez Vodnizza S, van der Horst-Bruinsma I. Sex differences in disease activity and efficacy of treatment in spondyloarthritis: is body composition the cause? Curr Opin Rheumatol (2020) 32(4):337–42. doi: 10.1097/bor.0000000000000717
- Moroni L, Farina N, Dagna L. Obesity and its role in the management of rheumatoid and psoriatic arthritis. Clin Rheumatol (2020) 39:1039–47. doi: 10.1007/s10067–020–04963–2
- Micheroli R, Hebeisen M, Wildi LM, Exer P, Tamborrini G, Bernhard J, et al. Impact of obesity on the response to tumor necrosis factor inhibitors in axial spondyloarthritis. Arthritis Res Ther (2017) 19(1):164. doi: 10.1186/s13075–017–1372–3
- Hu L, Ji X, Wang Y, Man S, Liu X, Wang L, et al. Underweight and obesity are strong predictors of clinical outcomes in patients with ankylosing spondylitis: data from the smart-phone spondyloarthritis management system. Ther Adv Musculoskelet Dis (2021) 13:1759720 × 211030792. doi: 10.1177/1759720 × 211030792
- Costa L, Caso F, Ramonda R, Del Puente A, Cantarini L, Darda MA, et al. Metabolic syndrome and its relationship with the achievement of minimal disease activity state in psoriatic arthritis patients: an observational study. Immunol Res (2015) 61(1–2):147–53. doi: 10.1007/s12026–014–8595-z
- Højgaard P, Glintborg B, Kristensen LE, Gudbjornsson B, Love TJ, Dreyer L. The influence of obesity on response to tumour necrosis factor-α inhibitors in psoriatic arthritis: results from the DANBIO and ICEBIO registries. Rheumatol (Oxford) (2016) 55(12):2191–9. doi: 10.1093/rheumatology/kew326
- Iannone F, Fanizzi R, Scioscia C, Anelli MG, Lapadula G. Body mass does not affect the remission of psoriatic arthritis patients on anti-TNF-α therapy. Scand J Rheumatol (2013) 42(1):41–4. doi: 10.3109/03009742.2012.715186
- Shan J, Zhang J. Impact of obesity on the efficacy of different biologic agents in inflammatory diseases: a systematic review and meta-analysis. Joint Bone Spine (2019) 86(2):173–83. doi: 10.1016/j.jbspin.2018.03.007
- Gratacós J, Galíndez E, Otón T. Is obesity a predictor for lack of response to treatment in psoriatic arthritis? a systematic review. Reumatol Clin (Engl Ed) (2021) 17(5):268–78. doi: 10.1016/j.reuma.2019.06.003
- Al-Mutairi N, Nour T. The effect of weight reduction on treatment outcomes in obese patients with psoriasis on biologic therapy: a randomized controlled prospective trial. Expert Opin Biol Ther (2014) 14(6):749–56. doi: 10.1517/14712598.2014.900541
11229010/SEC/DIG/07.24/0