Секукинумаб — полностью человеческое моноклональное антитело, прямо подавляющее интерлейкин 17A. Препарат продемонстрировал высокую эффективность и благоприятный профиль безопасности в клинической программе исследований фазы 3 у пациентов с псориатическим артритом (ПсА) и анкилозирующим спондилитом (АС)1,2.
SERENA — это текущее, длительное наблюдательное исследование, в котором приняли участие более 2900 пациентов, страдающих псориазом, ПсА и АС средней и тяжёлой степени. Исследование с ожидаемой продолжительностью до 5 лет проводилось в 438 центрах по всей Европе3,4.
Данный материал обобщает данные трёх лет наблюдения за уровнем удержания терапии и эффективностью секукинумаба, а также влияния перерывов в терапии у пациентов с ПсА и АС в исследовании SERENA5.
Дизайн исследования и пациенты
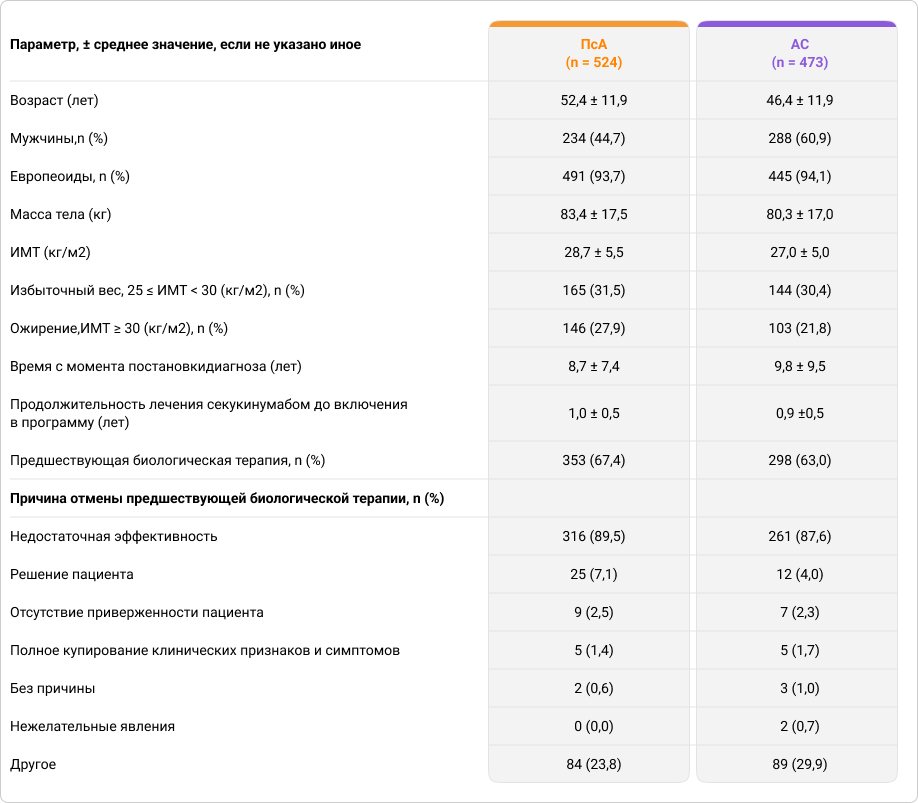
В исследование SERENA были включены 574 пациента с ПсА и 505 пациентов с АС в период с июля 2017 по октябрь 2018, которые находились под наблюдением в течение трёх и более лет, при этом в октябре 2021 был проведён промежуточный анализ. 524 пациента с ПсА и 473 пациента с АС полностью отвечали критериям включения/невключения для целевой популяции.
Пригодными для включения в исследование были пациенты в возрасте 18 лет и старше, которым был назначен секукинумаб в соответствии с инструкцией по медицинскому применению препарата, и получавшие данную терапию на протяжении 16 и более недель до момента включения.
Временным прекращением терапии считался перерыв в лечении секукинумабом на протяжении трёх и более месяцев с момента последней инъекции и до повторного назначения препарата. Уровень удержания терапии определялся как процент пациентов от общего числа участвующих в исследовании, которым не отменяли терапию секукинумабом.
Исходные характеристики пациентов
После включения в исследование терапию секукинумабом получали: в дозировке 150 мг — 101 (19,3%) пациент с ПсА и 460 (97,3%) пациентов с АС; в дозировке 300 мг — 422 (80,7%) пациента с ПсА и 13 (2,7%) пациентов с АС.
В течение 3 лет наблюдения дозировка секукинумаба не менялась у 449 (85,7%) пациентов с ПсА и у 397 (83,9%) пациентов с АС. Однократное изменение дозировки было отмечено у 54 (10,3%) пациентов с ПсА и 59 (12,5%) пациентов с АС. У 21 пациента (4,0%) с ПсА и у 17 пациентов с (3,6%) с АС дозировка секукинумаба была изменена более чем один раз.
Основная причина отмены ранее назначенной биологической терапии до начала лечения секукинумабом — её недостаточная эффективность (ПсА: 316 [89,5%]; АС: 261 [87,6%]).
Таблица 1. Исходные характеристики пациентов, принимающих участие в исследовании SERENA
Уровень удержания терапии секукинумабом
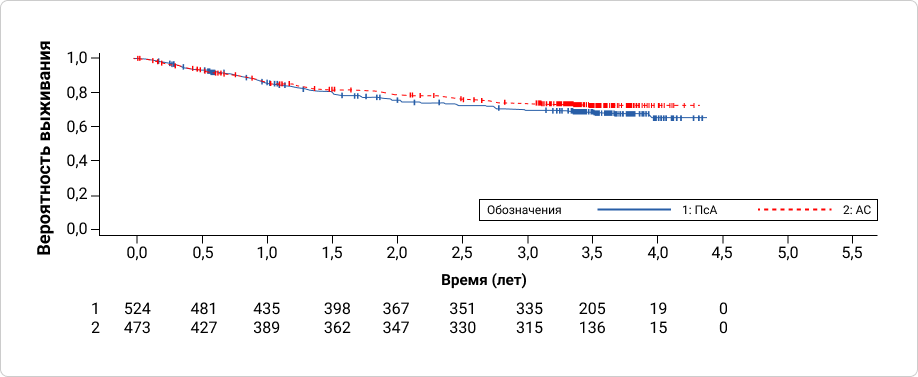
По прошествии трёх и более лет с момента включения в исследование уровень удержания терапии составил (95% CI) 67,3% (63,1%–71,6%) для пациентов с ПсА и 72,1% (67,8%–76,4%) для пациентов с АС.
По прошествии трёх и более лет с момента начала лечения секукинумабом (до включения в исследование), уровень удержания терапии составил (95% CI) 74,1% (70,2%–78,1%) для пациентов с ПсА и 77,4% (73,4%–81,4%) для пациентов с АС.
График 1. Кривые Каплана-Майера на графике демонстрируют уровень удержания терапии секукинумабом для пациентов, включенных в исследование
После более чем трехлетнего наблюдения в ходе исследования SERENA секукинумаб продемонстрировал высокие показатели удержания у реальной популяции с ПсА и АС.
Показатели эффективности терапии секукинумабом
Среднее (SD) число отечных суставов (SJC) у пациентов с ПсА составляло:
- исходно – 3,2 [5,6];
- через 2 года: 2,3 [4,1];
- через 3 года: 1,7 [2,7].
Среднее число болезненных суставов (TJC) у пациентов с ПсАсоставляло:
- исходно: 6,4 [9,4];
- через 2 года: 5,1 [6,3];
- через 3 года: 4,9 [6,4].
Сходная тенденция отмечалась и по показателям шкалы BАSDAI у пациентов с АС:
- исходно: 3,2 [2,3];
- через 2 года: 2,9 [2,3];
- через 3 года: 2,7 [2,2].
После более чем трехлетнего наблюдения в ходе исследования SERENA секукинумаб продемонстрировал устойчивую эффективность у реальной популяции с ПсА и АС.
Временное прекращение терапии секукинумабом
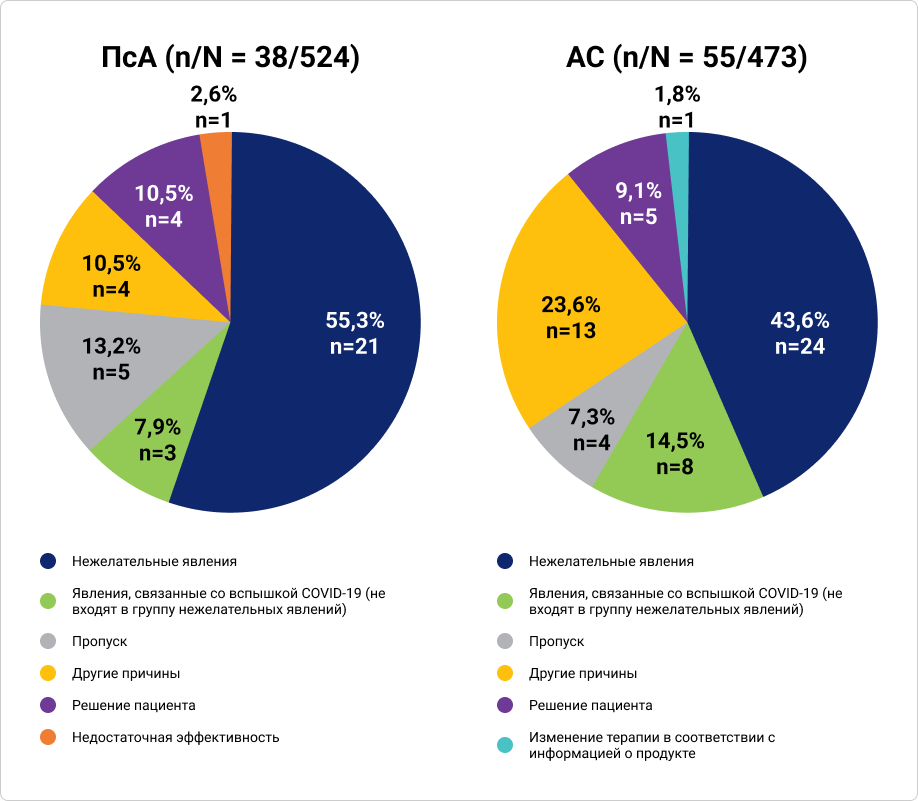
С момента включения в исследование и на протяжении трёх и более лет наблюдения терапия секукинумабом была прекращена один или более раз у 38 (7,3%) пациентов с ПсА и у 55 (11,6%) пациентов с АС. Основной причиной временного прекращения терапии являлись нежелательные явления у 21 (55,3%) пациента с ПсА и у 24 (43,6%) пациентов с АС.
График 2. Причины временного прекращения терапии секукинумабом у пациентов с ПсА и АС
При этом средняя длительность терапии секукинумабом составляла:
- у пациентов с ПсА — 675 дней до момента временного прекращения терапии и 557 дней после её возобновления;
- у пациентов с АС — 668 дней до момента временного прекращения терапии и 535 дней после её возобновления.
Средняя продолжительность временной отмены терапии у пациентов с ПсА и АС, которым возобновляли терапию с повторной нагрузочной дозы, составляла 183 дня для каждой нозологии. У пациентов, которым терапию возобновили сразу с поддерживающей дозы, средняя продолжительность временной отмены терапии была несколько меньше и составляла 106 для пациентов с ПсА и 92 дня для пациентов с АС.
Таблица 2. Временное прекращение терапии секукинумабом упациентов с ПсА и АС
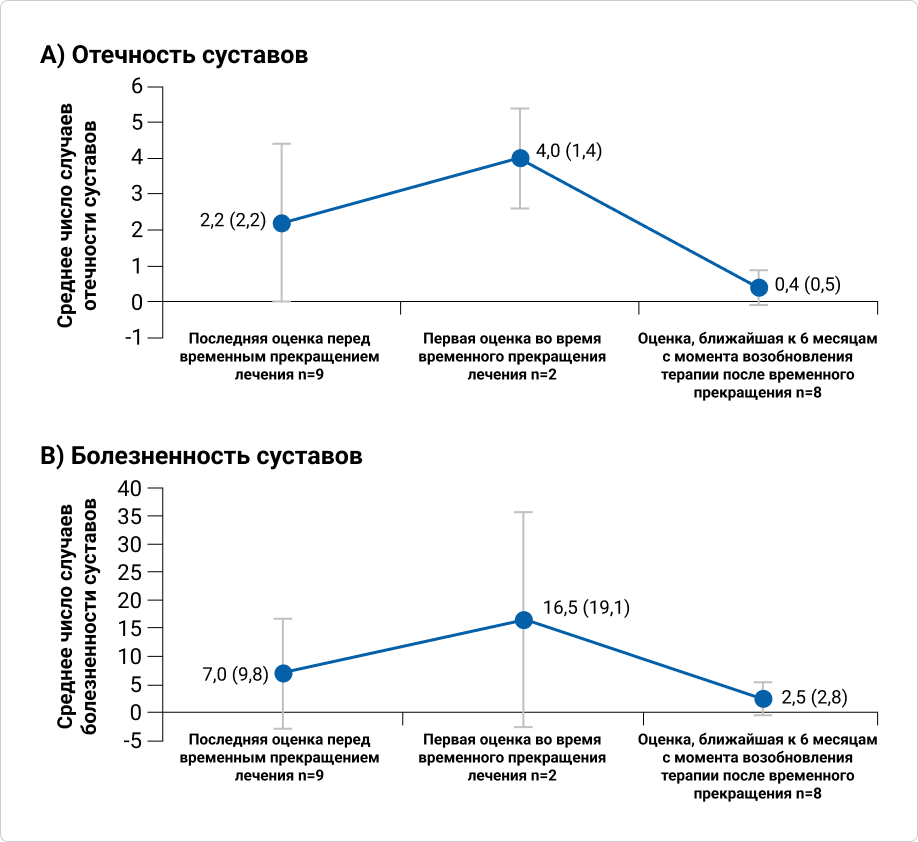
Число пациентов с ПсА, по которым имеются данные, было низким; следовательно, данные не могут быть окончательными.
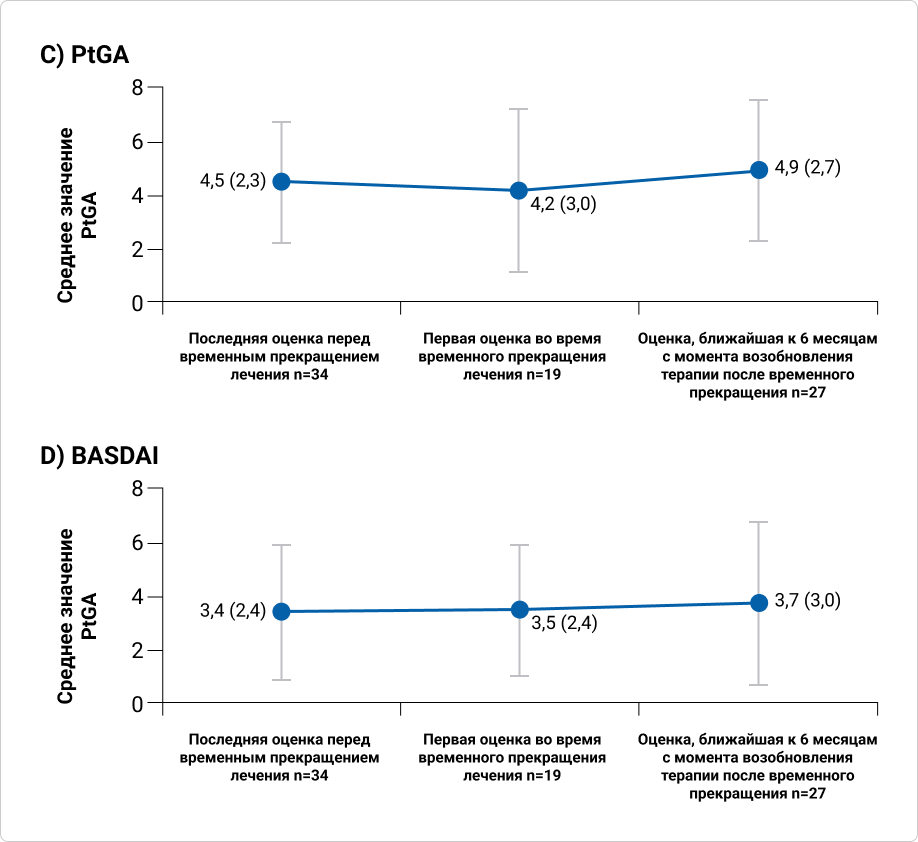
Среднее число случаев отёчности и болезненности суставов у пациентов с ПсА увеличивалось от момента последней оценки перед промежуточным перерывом в лечении и до первой оценки во время промежуточного перерыва в лечении и снижалось после возобновления терапии секукинумабом.
График 3. Эффективность терапии секукинумабом до временного прекращения лечения, в течение периода временного прекращения лечения и после его возобновления у пациентов с ПсА или АС
График 4. У пациентов с ПсА или АС, получавших секукинумаб и периодически прерывавших лечение по разным причинам, долгосрочная эффективность терапии сохранялась
До временной отмены лечения, в течение периода временной отмены лечения и после его возобновления у пациентов с ПсА или АС сохранялась долгосрочная эффективность терапии секукинумабом. Показатели PtGA и BАSDAI у пациентов с АС оставались стабильными с момента последней оценки перед временной отменой терапии до первой оценки в течение периода отмены и после возобновления терапии.
В ходе исследования SERENA секукинумаб при его применении в реальной популяции с ПсА и АС продемонстрировал:
- высокие показатели удержания терапии
- благоприятный профиль безопасности
- устойчивую эффективность
- сохранение долгосрочной эффективности терапии даже в случае временной отмены лечения.
Таким образом секукинумаб может рассматриваться как перспективный препарат для терапии пациентов с активным псориатическим артритом и анкилозирующим спондилитом.
Источники
- Mease P, van der Heijde D, Landewé R, Mpofu S, Rahman P, Tahir H, Singhal A, Boettcher E, Navarra S, Meiser K, Readie A, Pricop L, Abrams K. Secukinumab improves active psoriatic arthritis symptoms and inhibits radiographic progression: primary results from the randomised, double-blind, phase III FUTURE 5 study. Ann Rheum Dis. 2018 Jun;77(6):890-897. doi: 10.1136/annrheumdis-2017-212687. Epub 2018 Mar 17. PMID: 29550766; PMCID: PMC5965348.
- Pavelka K, Kivitz A, Dokoupilova E, Blanco R, Maradiaga M, Tahir H, Pricop L, Andersson M, Readie A, Porter B. Efficacy, safety, and tolerability of secukinumab in patients with active ankylosing spondylitis: a randomized, double-blind phase 3 study, MEASURE 3. Arthritis Res Ther. 2017 Dec 22;19(1):285. doi: 10.1186/s13075-017-1490-y. PMID: 29273067; PMCID: PMC5741872.
- Kiltz U, Sfikakis P.P., Gaffney K et al. Interim 2-Year Analysis from SERENA: A Real-World Study in Patients with Psoriatic Arthritis or Ankylosing Spondylitis Treated with Secukinumab. Rheumatol Ther 2022. https://doi.org/10.1007/s40744-022-00460-x.
- Augustin M, Sator PG, von Kiedrowski R, Conrad C, Rigopoulos D, Romanelli M, Ghislain PD, Torres T, Ioannides D, Aassi M, Schulz B, Jagiello P; SERENA study group. Secukinumab demonstrated sustained retention, effectiveness and safety in a real-world setting in patients with moderate-to-severe plaque psoriasis: long-term results from an interim analysis of the SERENA study. J Eur Acad Dermatol Venereol. 2022 Oct;36(10):1796-1804. doi: 10.1111/jdv.18329. Epub 2022 Jul 4. PMID: 35696305.
- Uta Kiltz et al. Poster #2241.5: Long-term Retention of Secukinumab and Effect of Treatment Interruption in Patients with Active Psoriatic Arthritis or Ankylosing Spondylitis: Results from the Observational SERENA Study, presented at ACR 2023.
772686/GenMed/DIG/02.24/0