Выживаемость пациентов с III стадией меланомы кожи зависит как от количества лимфатических узлов, вовлеченных в опухолевый процесс, так и от степени их поражения. Чем больше лимфатических узлов с метастазами, тем ниже выживаемость: 5-летняя меланома-специфическая выживаемость у пациентов с показателем N1 по классификации TNM составляет 82%, с N2 — 76% и с N3 — 57%1. Кроме того, прогноз при обнаружении макрометастазов обычно хуже, чем в случае микрометастазов: например, 5-летняя меланома-специфическая выживаемость у пациентов с показателем N1a составляет 84%, а с N1b — только 76%1.
Современные неинвазивные диагностические методы исследования, такие как ультразвуковое исследование регионарных лимфоузлов, прямая и непрямая лимфосцинтиграфия, КТ, МРТ, ПЭТ и др., характеризуются высокой (до 30%) частотой ложноотрицательных результатов при проверке регионарных лимфатических узлов на наличие метастазов меланомы кожи2. На сегодняшний день диагностическим стандартом для выявления регионарных лимфатических узлов с метастазами является биопсия сторожевых лимфатических узлов (БСЛУ)3, 4, 5.
Концепция сторожевого лимфатического узла
Считается, что метастазы в лимфатических узлах появляются последовательно по ходу движения лимфы от опухолевого очага. Первые лимфатические узлы по ходу движения лимфы от опухоли называют сторожевыми или сигнальными. При распространении по лимфатической системе опухолевые клетки обязательно пройдут через сторожевые лимфатические узлы, и именно в них появятся первые метастазы5, 6.
Концепция сторожевого лимфатического узла меняет подход к диагностике при меланоме кожи. Если при БСЛУ метастазы не обнаружены, то и в других лимфатических узлах их скорее всего нет3, 6.
Основная задача биопсии сторожевого лимфатического узла — определить, началось ли распространение опухоли по лимфатической системе.
Показания к выполнению БСЛУ при меланоме кожи
БСЛУ при меланоме кожи включена и в российские, и в зарубежные клинические рекомендации3, 4.
Каким именно пациентам необходимо проводить БСЛУ?
- Согласно российским клиническим рекомендациям показанием к выполнению БСЛУ является толщина меланомы по Бреслоу более 0,8 мм3.
- Согласно последним рекомендациям NCCN БСЛУ также показана при толщине опухоли по Бреслоу от 0,5 мм при наличии неблагоприятных прогностических признаков заболевания (возраст ≤ 42 года, локализация опухоли на голове/шее, лимфоваскулярная инвазия и (или) скорость митотического индекса ≥ 2/мм2)4.
Цели БСЛУ
У большинства пациентов с впервые диагностированной меланомой кожи наблюдается клинически локализованное заболевание. При этом у 15—20% таких пациентов уже могут иметься микрометастазы в лимфатических узлах5. БСЛУ была разработана как малоинвазивный метод выявления клинически не определяемых микрометастазов5, 6.
Важно отметить, что вероятность выявления метастазов в сторожевых лимфатических узлах зависит от толщины первичной меланомы7.
Таблица 1. Зависимость частоты выявления метастазов в СЛУ от толщины первичной меланомы7.
Если пациенту с меланомой кожи не выполнена БСЛУ (при наличии показаний к ее проведению согласно клиническим рекомендациям), параметр N по классификации TNM оценивается как Nx3.
Проведение БСЛУ позволяет правильно установить стадию заболевания и назначить наиболее эффективное лечение пациенту с меланомой кожи3, 6.
Так, выявление по результатам БСЛУ III стадии меланомы позволяет использовать дополнительную опцию лечения при BRAF+ меланоме — адъювантную таргетную терапию (ТТ)3, 6, применение которой у пациентов с меланомой кожи III стадии значительно увеличивает безрецидивную выживаемость (БРВ). Согласно данным исследования COMBI-AD у пациентов с меланомой III стадии 5-летняя БРВ в группе адъювантной ТТ комбинацией дабрафениб + траметиниб составила 52% против 36% в группе плацебо8.
Пример:
До проведения БСЛУ у пациента с меланомой кожи отсутствовали клинические изменения в лимфатических узлах. Учитывая толщину опухоли более 0,8 мм, решено было провести БСЛУ.
При выполнении БСЛУ выявлен один пораженный клинически не определяемый регионарный лимфатический узел. Установлена стадия заболевания — IIIA. Согласно клиническим рекомендациям3 было проведено тестирование на наличие в клетках меланомы мутации BRAF, выявлена мутация BRAF V600E.
До проведения БСЛУ по действующим клиническим рекомендациям пациенту не была показана адъювантная терапия3. После установления стадии меланомы IIIА по результатам БСЛУ пациенту может быть проведена адъювантная терапия, в том числе таргетная терапия комбинацией дабрафениб + траметиниб. Это лечение может улучшить прогноз заболевания. Например, в исследовании P. Grover адъювантная ТТ при меланоме IIIA стадии повысила 2-летнюю БРВ на 15% по сравнению с пациентами без адъювантной терапии и на 27% по сравнению с пациентами, получающими адъювантную иммуноонкологическую терапию (ИТ)9.
В литературе также имеются данные о том, что, помимо своей диагностической ценности, процедура БСЛУ может снизить риск рецидива меланомы10.
Нужно ли проводить БСЛУ при IIB/C стадиях меланомы кожи?
Согласно действующим клиническим рекомендациям после удаления меланомы кожи IIВ/С стадии пациентам показана адъювантная ИТ3. Может возникнуть вопрос о том, нужно ли выполнять БСЛУ в этом случае. Одной из целей БСЛУ является уточнение стадии заболевания для назначения адъювантной терапии в случае положительного результата. Зачем уточнять стадию заболевания, если и так можно провести адъювантную терапию?
Но все не так однозначно. Во‑первых, все исследования адъювантной ИТ включали пациентов с истинной II стадией, то есть всем пациентам была проведена БСЛУ. Во‑вторых, без выполнения БСЛУ и уточнения стадии заболевания мы теряем возможность назначить адъювантную ТТ, которая разрешена только с III стадии меланомы3. А у пациентов с III стадией адъювантная ТТ по большинству показателей эффективнее, чем ИТ9, 11–14. При обнаружении в процессе БСЛУ даже одного метастаза пациенту ставят стадию IIIА. Согласно клиническим рекомендациям3 для таких пациентов существуют две опции адъювантного лечения: комбинация дабрафениб + траметиниб и пембролизумаб. На ASCO 2023 были представлены результаты, подтверждающие преимущество адъювантной ТТ перед ИТ у пациентов с IIIА стадией: 1-летняя БРВ в группе адъювантной ТТ составила 100% против 91,4% в группе адъювантной ИТ, 2-летняя БРВ составила 98,5% против 71,6%, 2-летняя выживаемость без отдаленных метастазов 100% против 83,5% соответственно9.
Также не будем забывать, что БСЛУ сама по себе может выступать в качестве терапевтической процедуры, снижающей риск рецидива меланомы10.
Насколько эффективна БСЛУ?
Во многих исследованиях показано увеличение показателей БРВ, общей выживаемости (ОВ) и выживаемости, связанной с меланомой, у пациентов, которым проведена БСЛУ, по сравнению с пациентами в группах наблюдения. Большинство авторов объясняют это тем, что по результатам БСЛУ пациентам можно назначить терапию, соответствующую реальной стадии заболевания. Естественно, это приводит к наибольшей эффективности лечения5, 6, 15.
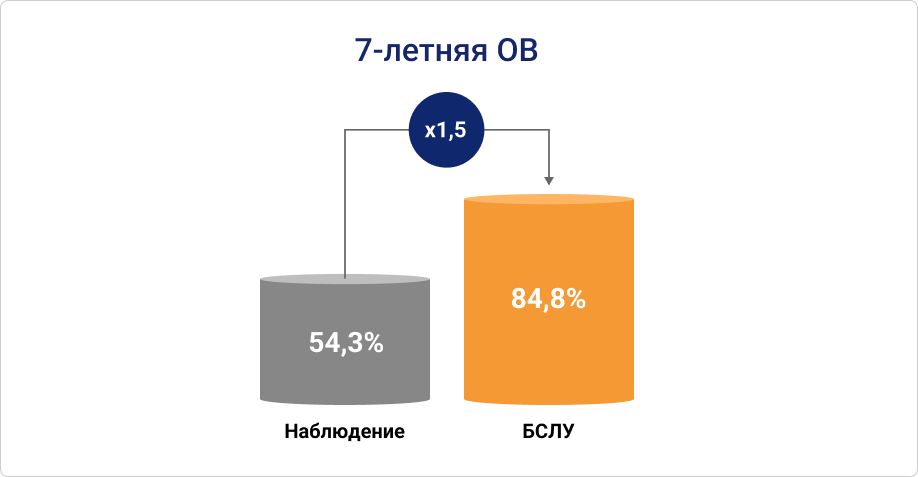
Согласно данным исследования российских ученых 7-летняя ОВ у пациентов, которым проводили БСЛУ, была в 1,5 раза выше, чем у пациентов в группе наблюдения16.
Рисунок 1. 7-летняя ОВ для пациентов, которых оставляли под наблюдением, и тех, кому выполняли БСЛУ16.
Методика БСЛУ
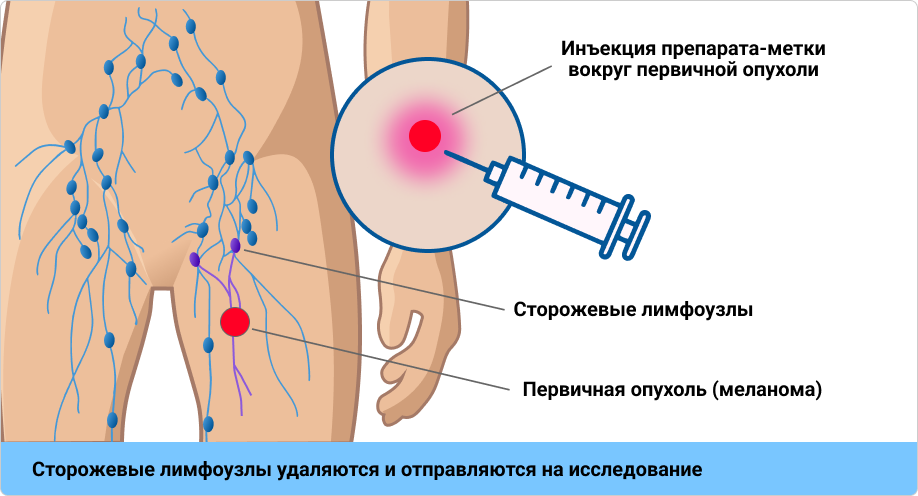
Методика БСЛУ основана на поиске сторожевых лимфатических узлов с помощью специального препарата-метки. Этот препарат вводят в окружающие опухоль ткани, и он распространяется от опухоли по лимфатической системе. Первые лимфатические узлы, в которых накапливается препарат-метка, — это и есть сторожевые лимфатические узлы. Именно они поражаются в первую очередь при распространении клеток меланомы по лимфатической системе. Результаты патоморфологического исследования найденных сторожевых лимфатических узлов позволяют определить, распространилась ли опухоль по лимфатической системе или нет17.
Рисунок 2. Методика проведения БСЛУ.
Препараты-метки для БСЛУ
Традиционно в качестве меток для БСЛУ применяют следующие группы препаратов:
Радиофармацевтические препараты наиболее эффективны для БСЛУ. Например, в исследовании Cloyd и соавт. частота обнаружения у пациента хотя бы одного сторожевого лимфатического узла составила 96,2% для технеция-99, 88,5% для индоцианового зеленого и только 59% для изосульфанового синего18.
В настоящее время продолжается поиск новых улучшенных методик проведения БСЛУ. Так, например, разработан «магнитный» метод БСЛУ. Он основан на применении в качестве маркера препарата, содержащего оксид железа, накопление которого обнаруживается в сторожевом лимфатическом узле с помощью интраоперационного магнита. Точность метода достигает 95%, и при этом, по данным разработчиков, он не обладает недостатками радиоизотопного метода19.
Особенности патоморфологического исследования при БСЛУ
Согласно клиническим рекомендациям при исследовании удаленного сторожевого лимфатического узла рекомендуется выполнить как можно больше срезов, а также, помимо окраски гематоксилином и эозином, использовать иммуногистохимическое окрашивание (даже при отсутствии признаков метастатического поражения) на меланома-специфические маркеры (Melan А, тирозиназа, НМВ45 или SОХ-10)3.
Оптимальные сроки выполнения БСЛУ
Среди исследователей нет единого мнения по поводу того, в какой срок после резекции первичного очага следует проводить БСЛУ20.
Есть вероятность того, что временной интервал, в течение которого проведена БСЛУ, может влиять на точность выявления пораженного сторожевого лимфатического узла, а также на размеры выявленных метастазов. Однако результаты исследований в этой области противоречивы и неоднозначны20.
Так, в 2022 году в исследовании El Sharouni и соавт. было показано, что в когорте голландских пациентов с меланомой кожи (n=1027) размеры метастазов, обнаруженных при проведении БСЛУ в течение 2 или 3 месяцев после хирургического удаления меланомы, были значительно больше (17—71%), чем у пациентов, которым БСЛУ проводили в течение 1 месяца после операции. Вместе с тем в том же исследовании в когорте пациентов из крупного австралийского центра лечения меланомы (n=541) не было обнаружено существенных различий в размерах метастазов, обнаруженных при БСЛУ, выполненной в разные сроки после резекции меланомы20.
У пациента положительная БСЛУ. Как дальше его лечить?
Варианты лечения пациентов с метастазами меланомы в сторожевых лимфатических узлахв настоящее время включают3, 4, 5:
- адъювантную таргетную терапию
- адъювантную иммуноонкологическую терапию
- наблюдение
- завершающую диссекцию лимфатических узлов
Необходима ли завершающая лимфаденэктомия у пациентов с опухолевым поражением сторожевых лимфатических узлов?
Однозначного ответа на этот вопрос нет. Согласно данным исследования MSLT-II, диссекция лимфатических узлов у пациентов с опухолевым поражением сторожевых лимфатических узлов приводит к некоторому увеличению БРВ: 3-летняя БРВ составила 68% в группе завершающей лимфаденэктомии против 63% в группе наблюдения. Вместе с тем лимфаденэктомия не повлияла на меланома-специфическую выживаемость: 3-летняя выживаемость в обеих группах составила 86%. При этом в группе завершающей лимфаденэктомии гораздо чаще развивались нежелательные явления, в частности лимфедема (24% против 6%). Последнее обстоятельство в сочетании с неоднозначным влиянием на показатели выживаемости ставит терапевтическую ценность завершающей лимфаденэктомии под большое сомнение21.
Российские клинические рекомендации также не дают однозначного ответа на этот вопрос. В случае обнаружения метастазов в сторожевом лимфатическом узле при выполнении БСЛУ для принятия решения о проведении лимфаденэктомии рекомендуется тщательно взвесить потенциальные риски и ожидаемую пользу от данной процедуры3, 6.
Основные выводы
- Всем пациентам с клинически локализованной меланомой кожи толщиной 0,8 мм и более рекомендована БСЛУ3.
- БСЛУ позволяет выявить клинически неопределяемые метастазы в сторожевых лимфатических узлах и уточнить стадию заболевания (III стадия при положительном результате)3.
- При III стадии меланомы кожи арсенал разрешенных видов лечения расширяется: для проведения адъювантной терапии BRAF+ меланомы начиная со стадии IIIА разрешено использовать таргетную терапию в целях снижения риска развития рецидива у пациентов3, 8.
- Вопрос о целесообразности проведения завершающей лимфаденэктомии при метастазах в сторожевых лимфатических узлах остается открытым3, 6, 21.
Список сокращений
- БРВ — безрецидивная выживаемость;
- БСЛУ — биопсия сторожевого лимфатического узла;
- ИТ — иммуноонкологическая терапия;
- ОВ — общая выживаемость;
- ТТ — таргетная терапия.
Источники
- Keung E. Z., Gershenwald J. E. The eighth edition American Joint Committee on Cancer (AJCC) melanomastaging system: implications for melanoma treatment and care //Expert review of anticancer therapy. — 2018. — Т. 18. — Vol. 8. — P. 775–784.
- Schuitevoerder D. et al. Patients with sentinel lymph node positive melanoma: who needs completion lymph node dissection? //The American Journal of Surgery. — 2018. — Т. 215. — № . 5. — С. 868–872.
- Клинические рекомендации Министерства здравоохранения РФ «Меланома кожи и слизистых оболочек» (дата обращения к сайту Рубрикатор КР (minzdrav.gov.ru) 06.02.2024).
- National Comprehensive Cancer Network et al. NCCN clinical practice guidelines in oncology (NCCN guidelines) // Melanoma: Cutaneous. Version 1.2024 — February 12, 2024.
- Morrison S., Han D. Re-evaluation of sentinel lymph node biopsy for melanoma //Current treatment options in oncology. — 2021. — Т. 22. — С. 1–19.
- Morton D. L. et al. Final trial report of sentinel-node biopsy versus nodal observation in melanoma //New England Journal of Medicine. — 2014. — Т. 370. — № . 7. — С. 599–609.
- Faries M. B., Morton D. L. Surgery and sentinel lymph node biopsy //Seminars in oncology. — WB Saunders, 2007. — Т. 34. — № . 6. — С. 498–508.
- Dummer R. et al. Five-year analysis of adjuvant dabrafenib plus trametinib in stage III melanoma //New England Journal of Medicine. — 2020. — Т. 383. — № . 12. — С. 1139–1148.
- Grover P. et al. Efficacy of adjuvant therapy in patients (pts) with AJCC v8 stage IIIA cutaneous melanoma. — 2023.
- Varey A. H. R. et al. Has the advent of modern adjuvant systemic therapy for melanoma rendered sentinel node biopsy unnecessary? //European Journal of Cancer. — 2023. — Т. 186. — С. 166–171.
- Dummer R. et al. Five-year analysis of adjuvant dabrafenib plus trametinib in stage III melanoma //New England Journal of Medicine. — 2020. — Т. 383. — № . 12. — С. 1139–1148.
- Long G. V. et al. Adjuvant dabrafenib plus trametinib in stage III BRAF-mutated melanoma //New England Journal of Medicine. — 2017. — Т. 377. — № . 19. — С. 1813–1823.
- Ascierto P. A. et al. Adjuvant nivolumab versus ipilimumab in resected stage IIIB-C and stage IV melanoma (CheckMate 238): 4-year results from a multicentre, double-blind, randomised, controlled, phase 3 trial //The Lancet Oncology. — 2020. — Т. 21. — № . 11. — С. 1465–1477.
- Eggermont A. M. M. et al. Longer follow-up confirms recurrence-free survival benefit of adjuvant pembrolizumab in high-risk stage III melanoma: updated results from the EORTC 1325–MG/KEYNOTE-054 trial //Journal of Clinical Oncology. — 2020. — Т. 38. — № . 33. — С. 3925.
- Murtha T. D., Han G., Han D. Predictors for use of sentinel node biopsy and the association with improved survival in melanoma patients who have nodal staging //Annals of surgical oncology. — 2018. — Т. 25. — С. 903–911.
- Кудрявцев Д.В. и др. Биопсия сторожевых лимфатических узлов в профилактике регионарных рецидивов у больных с локализованной меланомой кожи //Вестник рентгенологии и радиологии. — 2017. — Т. 98. — № . 6. — С. 303–309.
- Эберт М.А. и др. Биопсия сторожевого лимфоузла при меланоме кожи: опыт одного центра //Эффективная фармакотерапия. — 2021. — Т. 17. — № . 11. — С. 16–21.
- Cloyd J. M. et al. Indocyanine green and fluorescence lymphangiography for sentinel lymph node identification in cutaneous melanoma //Journal of Surgical Oncology. — 2014. — Т. 110. — № . 7. — С. 888–892.
- Афанасьева К.В. и др. Виды биопсии сторожевого лимфатического узла при раке молочной железы //Российский онкологический журнал. — 2014. — Т. 19. — № . 2. — С. 46–51.
- El Sharouni M. A. et al. Original Research Effect of the time interval between melanoma diagnosis and sentinel node biopsy on the size of metastatic tumour deposits in node-positive patients //EUROPEAN JOURNAL OF CANCER. — 2022. — Т. 167. — С. 133–141.
- Faries M. B. et al. Completion dissection or observation for sentinel-node metastasis in melanoma //New England Journal of Medicine. — 2017. — Т. 376. — № . 23. — С. 2211–2222.
11229305/ONCO/DIG/07.24/0