Введение
Согласно клиническим рекомендациям Минздрава России после удаления меланомы кожи III стадии показано проведение адъювантной терапии (АТ) с целью снижения риска рецидива заболевания. Пациентам с IIIА стадией и выше с мутацией в гене BRAF может быть назначена адъювантная таргетная терапия (ТТ) комбинацией дабрафениб + траметиниб или иммуноонкологическая терапия (ИТ) пембролизумабом. Начиная с IIIВ стадии появляется еще одна опция АТ: ИТ ниволумабом1. Таким образом, для выбора оптимального варианта АТ важно точно определить стадию заболевания. При толщине меланомы от 0,8 мм обязательным диагностическим исследованием для этого является биопсия сторожевых лимфатических узлов (БСЛУ)1.
Рисунок 1. Опции АТ после удаления меланомы кожи III стадии.
Как же определить, какая АТ будет оптимальна в каждом конкретном случае и от чего это зависит? В настоящее время нет данных прямых сравнительных клинических исследований различных опций АТ после резекции меланомы кожи III стадии. Но мы можем самостоятельно провести непрямое сравнение результатов ключевых клинических исследований трех вариантов АТ:
- дабрафениб + траметиниб (COMBI-AD)2, 3;
- пембролизумаб (Keynote-054)4, 5, 6;
- ниволумаб (CheckMate 238)7, 8.
Непрямое сравнение эффективности адъювантной ИТ и ТТ по данным клинических исследований
В исследованиях COMBI-AD2, 3, Keynote-0544, 5, 6 и СheckMate 2387, 8 пациенты получали 12-месячный курс АТ. После завершения лечения пациенты продолжали находиться под наблюдением.
К настоящему времени доступны данные 7-летнего (Keynote-054), 7-летнего (СheckMate 238) и 8-летнего (COMBI-AD) наблюдения за пациентами, включенными в указанные исследования. Самый продолжительный период наблюдения за пациентами, получавшими АТ после резекции меланомы кожи, — 8 лет в исследовании COMBI-AD3.
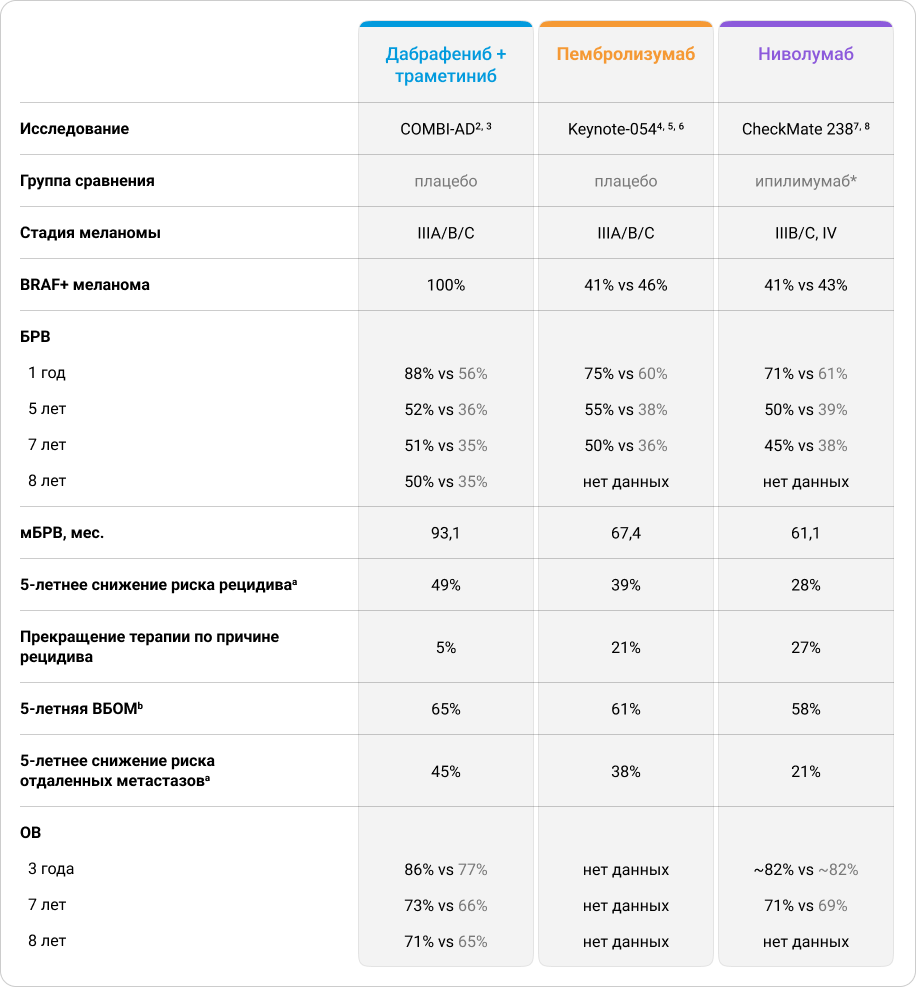
Основные показатели эффективности АТ в этих исследованиях приведены в таблице 1.
Таблица 1. Непрямое сравнение эффективности АТ после резекции меланомы кожи в ключевых клинических исследованиях COMBI-AD, Keynote-054 и СheckMate 238.
* Ипилимумаб в РФ не разрешен для АТ.
a В исследованиях COMBI-AD и Keynote-054 риски были рассчитаны относительно пациентов, получающих плацебо, а в исследовании СheckMate 238 — относительно пациентов, получавших лекарственный препарат ипилимумаб.
b Методика определения ВБОМ различалась в трех обсуждаемых исследованиях. В исследованиях COMBI-AD и СheckMate 238 из анализа ВБОМ были исключены пациенты с развившимся местным рецидивом; в исследовании Keynote-054 в анализ были включены все пациенты, независимо от того, развивался у них местный рецидив или нет.
Обратим внимание, что в исследовании COMBI-AD все пациенты были с положительным статусом BRAF, а в исследованиях Keynote-054 и СheckMate 238 таких пациентов было меньше половины. При этом наличие у пациента мутации в гене BRAF является фактором неблагоприятного прогноза, и у таких пациентов гораздо чаще возникают рецидивы меланомы кожи после проведенной резекции9.
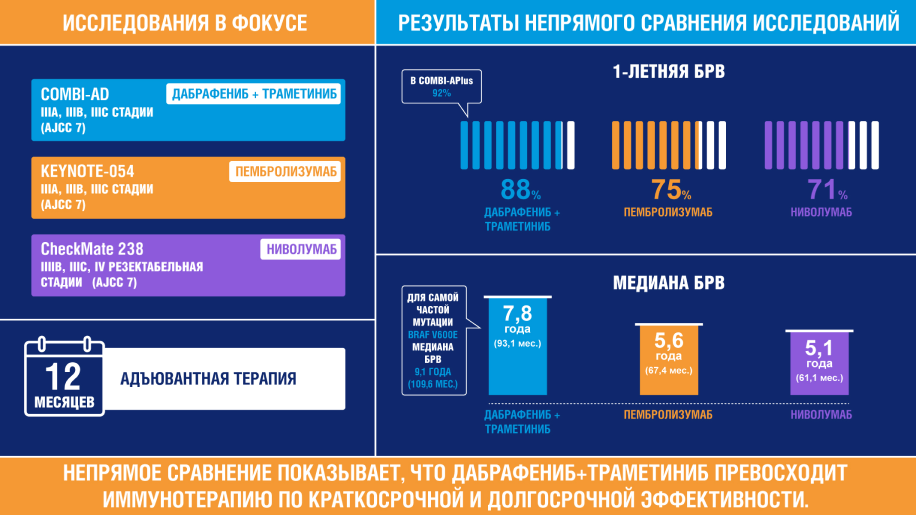
Непрямое сравнение краткосрочной эффективности разных вариантов АТ в клинических исследованиях показало преимущество адъювантной ТТ комбинацией дабрафениб + траметиниб перед другими видами АТ2—8. Рассмотрим полученные результаты подробнее.
1 год наблюдения
1-летняя безрецидивная выживаемость (БРВ). В период проведения АТ (12 месяцев) частота рецидивов у пациентов, получавших ТТ, была существенно ниже, чем у пациентов получавших ИТ: 1-летняя БРВ 88% против 71—75%2—8. В исследовании COMBI-APlus был применен новый алгоритм управления пирексией. Как следствие, меньшее количество пациентов прекратили таргетную терапию из-за данного нежелательного явления (НЯ), и результаты лечения были еще более впечатляющие: 1-летняя БРВ 92%10.
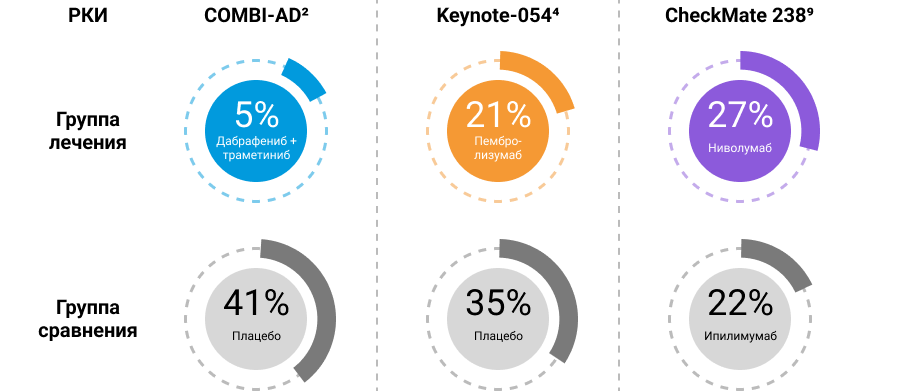
Досрочное завершение лечения из-за рецидива меланомы кожи — еще один показатель краткосрочной эффективности АТ2, 4, 9. Всего 5% пациентов прекращали АТ дабрафенибом и траметинибом в связи с возникновением рецидива2.
Рисунок 2. Досрочное завершение лечения из-за рецидива меланомы кожи.
Последующее наблюдение за пациентами в обсуждаемых клинических исследованиях подтвердило, что проведение АТ снижает риск развития как локорегионарных, так и отдаленных метастазов меланомы кожи. При непрямом сравнении показатели эффективности ТТ были выше аналогичных показателей ИТ2—8.
5 лет наблюдения
5-летнее снижение риска рецидива. Проведение адъювантной ТТ снижало 5-летний риск рецидива в большей степени, чем ИТ: 49% для ТТ комбинацией дабрафениб + траметиниб против 39% для ИТ пембролизумабом2—5.
5-летнее снижение риска отдаленных метастазов. ТТ также была более эффективна в отношении отдаленных метастазов: 5-летнее снижение риска составило 45% для ТТ комбинацией дабрафениб + траметиниб против 38% для ИТ пембролизумабом2—6, 17.
Мы не можем провести корректное сравнение величин снижения рисков рецидива и отдаленных метастазов с ИТ ниволумабом, поскольку в исследовании CheckMate 238 риски были рассчитаны относительно лекарственного препарата — ипилимумаба, а не относительно плацебо, как в других исследованиях5, 7.
8 лет наблюдения
8-летняя БРВ. 8-летние данные наблюдения пока опубликованы только для исследования COMBI-AD, и их можно сравнить только с группой плацебо: 50% против 35%3. К 8 годам снижение риска рецидива остается по прежнему высоким и составляет 48%3.
Медиана БРВ (мБРВ). Разная продолжительность наблюдения за пациентами в вышеуказанных клинических исследованиях осложняет сравнение эффективности АТ по БРВ в поздние периоды наблюдения (7—8 лет) из-за отсутствия некоторых данных. Вместе с тем мБРВ уже достигнута во всех исследованиях, так что мы имеем возможность сравнить эффективность лечения по данному показателю. У пациентов, получавших ТТ, мБРВ в 1,5 раза выше, чем при ИТ: 93,1 месяца против 61,1—67,4 месяца3, 4, 7.
Скорость развития рецидивов на разных сроках наблюдения. Интересно, что после 3 лет наблюдения показатели БРВ у пациентов, получивших ТТ, выходят на плато. Особенно это заметно начиная с 5 лет наблюдения: 52%, 51% и 50% через 5, 7 и 8 лет после начала ТТ — за 3 года всего 2% рецидивов3. Такая тенденция позволяет ожидать, что и в дальнейшем у этих пациентов рецидивы, скорее всего, будут развиваться крайне редко. Совсем другая картина наблюдается после ИТ: всего за 2 года (в период с 5 до 7 лет наблюдения) рецидивы развились у 5% пациентов7, 8.
Сравнение эффективности адъювантной ИТ и ТТ в реальной клинической практике
Мы провели непрямое сравнение эффективности различных вариантов АТ после резекции меланомы кожи в клинических исследованиях. Возникает вопрос: подтверждаются ли эти результаты данными реальной клинической практики? Ведь характеристики пациентов, получающих АТ в реальных условиях, могут отличаться от жестких критериев включения в клинические исследования, и это может влиять на эффективность терапии.
В ряде исследований реальной клинической практики, проведенных в различных странах мира11—13, подтверждено преимущество адъювантной ТТ перед адъювантной ИТ после удаления меланомы кожи. Согласно результатам этих исследований мБРВ у пациентов, получивших адъювантную ТТ, превышает аналогичный показатель у пациентов, получивших ИТ, на 6—14 месяцев12, 13. При этом эффективность по показателю 2-летней БРВ для адъювантной ТТ в реальности соответствует или выше показателя, полученного в клинических исследованиях (66—75% против 67%)11, 13, 14, а для ИТ — соответствует или ниже (56—64% против 62—68%)11, 15, 16.
Сравнение безопасности адъювантной ИТ и ТТ
При назначении АТ важным аспектом является профиль безопасности, особенно в долгосрочном периоде.
Частота развития в период проведения АТ любых НЯ и НЯ ≥ 3 степени, а также спектр НЯ в целом были сопоставимы во всех рассматриваемых исследованиях2—9. Однако у профиля безопасности каждого вида АТ имеются и свои особенности.
Так, самым частым НЯ при адъювантной ТТ является пирексия. В исследовании COMBI-AD 8,7% пациентов были вынуждены прекратить терапию в связи с развитием пирексии2, 3. Однако впоследствии был разработан адаптированный алгоритм управления пирексией, и в более поздних исследованиях (COMBI-APlus) с применением нового алгоритма доля пациентов, прекративших лечение из-за пирексии, составила всего 2,2%10.
Для ИТ характерны другие особенности развития НЯ. Так, на фоне ИТ часто развиваются специфические иммуноопосредованные НЯ (иоНЯ), связанные с суперактивацией иммунной системы пациента. Особенностью иоНЯ является высокая частота перехода в хроническую форму. До 46% пациентов17—19, получающих лечение ИТ, сталкиваются с хроническими иоНЯ, которые могут в 30% случаев перейти в стойкие иоНЯ и оставаться с пациентом более 1,5 лет после отмены терапии10. Это может снижать качество жизни20.
Для некоторых пациентов этот риск даже выше, чем в среднем по популяции. Важно до назначения АТ выявлять таких пациентов и с особым вниманием подходить к выбору для них варианта лекарственной терапии, тщательно взвешивая возможные пользу и риски от ИТ.
Алгоритм выбора адъювантной терапии резектабельной меланомы кожи III стадии
Итак, подведем итоги. Как выбрать оптимальный вариант АТ после удаления меланомы кожи?
Точно установить стадию заболевания
(БСЛУ обязательна при толщине меланомы от 0,8 мм1)
У 12—44% пациентов (в зависимости от толщины первичной меланомы) проведение БСЛУ приводит к обнаружению метастазов в сторожевых лимфоузлах — а это уже III стадия меланомы21.
Определить BRAF-статус меланомы
(тест на мутацию BRAF обязателен начиная с IIIA стадии1)
Определить, какие опции АТ доступны при установленной стадии меланомы и статусе BRAF
- IIIA — дабрафениб + траметиниб, пембролизумаб
- IIIB, IIIC/D — дабрафениб + траметиниб, пембролизумаб, ниволумаб
Сравнить показатели эффективности возможных вариантов АТ
Согласно данным клинических исследований у пациентов с BRAF+ меланомой начиная с IIIA стадии АТ комбинацией дабрафениб + траметиниб демонстрирует преимущество перед ИТ анти-PD-1 препаратами2—9:
- 1-летняя БРВ 92% против 71—75%
- мБРВ 93,1 месяца против 61,1—67,4 месяца
Оценить безопасность возможных вариантов АТ
(с учетом факторов риска развития иоНЯ)
Согласно данным клинических исследований НЯ на фоне адъювантной ТТ контролируемы, управляемы и обратимы. Клинические исследования также показывают, что при проведении ИТ почти половина (более 40%17—19) пациентов сталкивается с хроническими иоНЯ, которые могут снижать качество жизни пациентов20.
Список сокращений
- АТ — адъювантная терапия;
- БРВ — безрецидивная выживаемость;
- БСЛУ - биопсия сторожевых лимфатических узлов;
- ВБОМ — выживаемость без отдаленных метастазов;
- иоНЯ — иммуноопосредованные нежелательные явления;
- ИТ — иммуноонкологическая терапия;
- мБРВ — медиана безрецидивной выживаемости;
- НЯ — нежелательные явления;
- ОВ — общая выживаемость;
- ТТ — таргетная терапия.
Список литературы
- Клинические рекомендации Меланома кожи и слизистых оболочек МЗ РФ 2023 — https://cr.minzdrav.gov.ru/schema/546_3 [Дата доступа: 21 июля 2024 г.].
- Dummer R. et al. Five-year analysis of adjuvant dabrafenib plus trametinib in stage III melanoma // New England Journal of Medicine. — 2020. — Т. 383. — № . 12. — С. 1139–1148.
- Long G. V. et al. Final Results for Adjuvant Dabrafenib plus Trametinib in Stage III Melanoma // New England Journal of Medicine. — 2024.
- Eggermont A. M. M. et al. Longer follow-up confirms recurrence-free survival benefit of adjuvant pembrolizumab in high-risk stage III melanoma: updated results from the EORTC 1325–MG/KEYNOTE-054 trial // Journal of clinical oncology. — 2020. — Т. 38. — № . 33. — С. 3925.
- Eggermont A. M. M. et al. Five-year analysis of adjuvant pembrolizumab or placebo in stage III melanoma //NEJM evidence. — 2022. — Т. 1. — № . 11. — С. EVIDoa2200214.
- Eggermont A. M. M. et al. Seven-year analysis of adjuvant pembrolizumab versus placebo in stage III melanoma in the EORTC1325/KEYNOTE-054 trial //European Journal of Cancer. – 2024. – С. 114327.
- Ascierto P. A. et al. 1089P Adjuvant nivolumab (NIVO) vs ipilimumab (IPI) in resected stage III/IV melanoma: 7-y results from CheckMate 238 // Annals of Oncology. — 2023. — Т. 34. — С. S656.
- Webber J. et al. Five-year outcomes with adjuvant nivolumab versus ipilimumab in resected stage III B-C or IV melanoma (CheckMate 238). Presented at SMR 2021.
- Ascierto P. A. et al. Adjuvant nivolumab versus ipilimumab in resected stage IIIB-C and stage IV melanoma (CheckMate 238): 4-year results from a multicentre, double-blind, randomised, controlled, phase 3 trial // The Lancet Oncology. — 2020. — Т. 21. — № . 11. — С. 1465–1477.
- Atkinson V. et al. Improved pyrexia-related outcomes associated with an adapted pyrexia adverse event management algorithm in patients treated with adjuvant dabrafenib plus trametinib: Primary results of COMBI-APlus // European Journal of Cancer. — 2022. — Т. 163. — С. 79–87.
- Placzke J. et al. Modern approach to melanoma adjuvant treatment with anti-PD1 immune check point inhibitors or BRAF/MEK targeted therapy: multicenter real-world report // Cancers. — 2023. — Т. 15. — № . 17. — С. 4384.
- Haist M. et al. Treatment management for BRAF-mutant melanoma patients with tumor recurrence on adjuvant therapy: a multicenter study from the prospective skin cancer registry ADOREG // Journal for Immunotherapy of Cancer. — 2023. — Т. 11. — № 9.
- Bai X. et al. Dabrafenib plus trametinib versus anti-PD–1 monotherapy as adjuvant therapy in BRAF V600-mutant stage III melanoma after definitive surgery: a multicenter, retrospective cohort study // EClinicalMedicine. — 2023. — Т. 65.
- Long G. V. et al. Adjuvant dabrafenib plus trametinib in stage III BRAF-mutated melanoma // New England Journal of Medicine. — 2017. — Т. 377. — № . 19. — С. 1813–1823.
- Eggermont A. M. M. et al. Adjuvant pembrolizumab versus placebo in resected stage III melanoma (EORTC 1325–MG/KEYNOTE-054): distant metastasis-free survival results from a double-blind, randomised, controlled, phase 3 trial // The Lancet oncology. — 2021. — Т. 22. — № . 5. — С. 643–654.
- Weber J. et al. Adjuvant nivolumab versus ipilimumab in resected stage III or IV melanoma // New England Journal of Medicne. — 2017. — Т. 377. — № . 19. — С. 1824–1835.
- Goodman R.S. et al. Extended Follow-Up of Chronic Immune-Related Adverse Events Following Adjuvant Anti-PD–1 Therapy for High-Risk Resected Melanoma // JAMA Network Open. — 2023. — Т. 6. — № . 8. — С. e2327145-e2327145.
- Patrinely J. R. et al. Chronic immune-related adverse events following adjuvant anti-PD–1 therapy for high-risk resected melanoma // JAMA oncology. — 2021. — Т. 7. — № . 5. — С. 744–748.
- Tong J. et al. Long-term toxicities of immune checkpoint inhibitor (ICI) in melanoma patients // Current Oncology. — 2022. — Т. 29. — № . 10. — С. 7953–7963.
- Schulz T. U. et al. Persistent immune-related adverse events after cessation of checkpoint inhibitor therapy: prevalence and impact on patients' health-related quality of life // European Journal of Cancer. — 2022. — Т. 176. — С. 88–99.
- Faries M. B., Morton D. L. Surgery and sentinel lymph node biopsy //Seminars in oncology. — WB Saunders, 2007. — Т. 34. — № . 6. — С. 498–508.
11338308/ONCO/DIG/12.24/0